Химические эксперименты играют важную роль в изучении свойств и реакций металлов главных подгрупп. Они позволяют студентам получить практические навыки в работе с различными металлическими соединениями и определить их физико-химические характеристики. Экспериментальные задачи помогают студентам лучше понять особенности химических процессов, происходящих в металлах и их соединениях, а также развивают навыки самостоятельной работы и анализа полученных результатов.
В рамках практической работы по химии студентам предлагается выполнить ряд экспериментов с металлами главных подгрупп. Например, задачей может быть определение активности и реакционной способности различных металлов. Для этого необходимо подготовить растворы металлов и исследовать их реакции с различными химическими веществами. Экспериментальные данные помогут студентам сравнить активность металлов и сделать выводы о их химической активности.
Другой интересной задачей может быть исследование свойств и структуры металлических соединений. Например, студентам предлагается получить и проанализировать различные вещества, содержащие металлы главных подгрупп. Путем исследования физико-химических свойств и структуры материала студенты смогут определить его состав и свойства, а также проанализировать причины возможных изменений в процессе взаимодействия металла с другими веществами.
Реакции металлов и кислорода

Реакции металлов с кислородом являются одним из основных способов получения оксидов металлов. Кислород является одним из самых распространенных элементов и способен взаимодействовать с большим количеством металлов.
При контакте металла с кислородом происходит окисление металла, при этом образуются оксиды металлов. Оксид металла обладает различными физическими и химическими свойствами и находит широкое применение в различных отраслях промышленности.
Реакция металлов с кислородом происходит при повышенных температурах или при наличии катализаторов. В некоторых случаях, для проведения реакции металлы могут быть обработаны соляной или серной кислотой, чтобы увеличить скорость реакции.
В результате реакции металлов с кислородом образуется оксид металла, который может быть использован для получения дальнейших химических соединений или применен в других процессах. Эта реакция является важным этапом в производстве многих продуктов, таких как сталь, алюминий, медь и т.д.
В таблице представлены некоторые примеры реакций металлов с кислородом:
| Металл | Формула оксида |
|---|---|
| Магний | MgO |
| Алюминий | Al2O3 |
| Железо | Fe2O3 |
| Медь | CuO |
Вывод: реакции металлов с кислородом являются важным практическим аспектом химии металлов. Они позволяют получать оксиды металлов, которые имеют широкий спектр применения и являются основными компонентами многих материалов и продуктов.
Восстановительные свойства металлов
Восстановительные свойства металлов являются одними из наиболее важных химических свойств данных элементов. Благодаря этим свойствам металлы могут проявлять стойкий интерес в различных отраслях производства, включая металлургию, электролитическую промышленность, химическую промышленность и так далее.
В процессе восстановления металлы способны принимать электроны от других веществ, что приводит к изменению их степени окисления. Этими свойствами металлов воспользуются в химических реакциях, где металлы действуют в качестве восстановителей. Например, металлический натрий может принять электроны от хлора и образовать хлорид натрия.
Восстановительные свойства металлов зависят от их электрохимического потенциала, который определяет их способность принимать электроны. Чем ниже потенциал, тем сильнее металл будет стремиться к восстановлению. Например, натрий с более низким потенциалом восстановления будет более активным восстановителем, чем железо с более высоким потенциалом.
Восстановительные свойства металлов можно изучить с помощью различных лабораторных экспериментов. Например, можно провести эксперимент по определению активности металлов в реакции с растворами ионов металлов. Для этого проводятся коррозионные испытания, при которых металлы погружаются в растворы и запускается процесс восстановления. Полученные данные позволяют сравнить активность различных металлов и определить их способность к восстановлению.
Эксперименты с коррозией металлов

Коррозия металлов – это процесс их разрушения под воздействием окружающей среды. Для исследования коррозионной стойкости металлов проводятся различные эксперименты.
Один из таких экспериментов – определение влияния различных растворов на скорость коррозии. Для этого используются специальные системы, где металлы погружаются в растворы разной концентрации. Путем измерения скорости коррозии можно оценить стойкость металла к воздействию определенных веществ.
Другой эксперимент – определение влияния окружающей среды на коррозию металлов. В данном случае металлы размещаются в разных условиях: влажность, температура, наличие газов и прочие факторы могут влиять на скорость разрушения. В результате эксперимента можно сделать выводы о наиболее оптимальных условиях для хранения или использования металлических изделий.
Еще один метод исследования коррозии металлов – анализ поверхности. С помощью микроскопии или электронной микроскопии можно изучить мельчайшие детали структуры поверхности металла и выявить наличие коррозионных процессов. Такой анализ позволяет более точно оценить степень повреждения и выработать методы защиты от коррозии.
Изучение процессов коррозии металлов является важной задачей, поскольку коррозия приводит к экономическим потерям и ухудшает функциональные свойства металлических изделий. Проведение экспериментов помогает разработать методы защиты от коррозии и создать более стойкие металлические материалы для разных сфер применения.
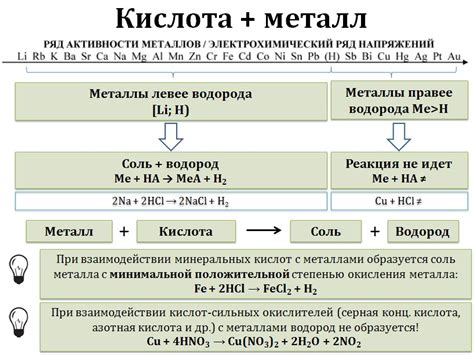
Реакции металлов с неорганическими кислотами
Металлы – это элементы, которые могут образовывать катионы с положительным зарядом в растворе. Реакция металлов с неорганическими кислотами представляет собой процесс, при котором металлы вступают в реакцию с кислотами, образуя соли и выделяя газы.
Один из примеров такой реакции – реакция цинка с соляной кислотой. При взаимодействии цинка и соляной кислоты образуется хлорид цинка и выделяется водородный газ. Уравнение реакции имеет вид:
Zn + 2HCl → ZnCl2 + H2
Эта реакция происходит при обычных условиях и является типичной для многих металлов. Она относится к типу реакций, называемых замещением одного элемента другим.
Другим примером реакции металла с неорганической кислотой является реакция железа с серной кислотой. При этой реакции образуется сульфат железа и выделяется сернистый газ. Уравнение реакции выглядит следующим образом:
Fe + H2SO4 → FeSO4 + SO2
Такие реакции металлов с неорганическими кислотами используются не только в химических экспериментах, но и в промышленности. Например, реакция цинка с соляной кислотой применяется при очистке металлических поверхностей от окислов и нагара, а реакция железа с серной кислотой используется для получения сульфата железа – одного из важных химических соединений.
Взаимодействие металлов с органическими кислотами

Органические кислоты могут взаимодействовать с различными металлами, приводя к образованию солей. Это взаимодействие может протекать как в водных растворах, так и в твердом состоянии при высоких температурах.
При взаимодействии металлов с органическими кислотами обычно происходит замещение водорода в кислоте на металл. Таким образом, образуются соли, которые могут обладать различными свойствами, в зависимости от свойств металла и кислоты.
Например, карбонаты металлов реагируют с карбоновыми кислотами, образуя соли и выделяя углекислый газ. Это реакция можно наблюдать в виде появления пузырьков газа при контакте кислоты с металлическим карбонатом.
Способность металлов вступать во взаимодействие с органическими кислотами может быть использована для определения содержания данного металла в образце. Например, можно протестировать различные органические кислоты на наличие реакции с металлами и определить, какие из них образуют соли.
Изучение взаимодействия металлов с органическими кислотами имеет практическое значение, так как позволяет понять, какие вещества могут использоваться для получения солей металлов, а также какие вещества обладают свойствами кислоты и могут реагировать с металлами.
Реакции солями металлов
Соли металлов представляют собой соединения металлов с кислотами. Они являются основными карбонатами, сульфатами, нитратами, хлоридами и другими химическими компонентами. Реакции солями металлов находят широкое применение в различных областях науки и технологий.
При взаимодействии солями металлов с кислотами образуются соответствующие соли. Например, реакция между хлоридом меди(II) и серной кислотой приводит к образованию сульфата меди(II). Эта реакция может быть использована для получения сульфата меди(II) в лабораторных условиях.
Соли металлов также могут взаимодействовать с другими химическими соединениями. Например, реакция между хлоридом железа(III) и калиевым гидроксидом приводит к образованию гидроксида железа(III). Эта реакция может быть использована для определения содержания железа в образцах.
Реакции солями металлов имеют важное практическое значение для различных отраслей промышленности. Например, в производстве стекла используется реакция между хлоридом калия и оксидом кремния для получения кремния из стекла. Этот процесс называется кремниевой шлаковой реакцией и является одним из ключевых этапов в производстве стекла.
Взаимодействие металлов с щелочами и щелочноземельными металлами
Взаимодействие металлов с щелочными и щелочноземельными металлами является одной из основных тем в химии. Эти реакции позволяют изучить способность металлов образовывать ионы, а также определить их реакционную способность.
В ходе экспериментов с щелочами и щелочноземельными металлами можно наблюдать различные взаимодействия. Например, при взаимодействии натрия с водой происходит сильное газообразование, а при реакции кальция с водой образуется гидроксид кальция, который набухает и разрушается на мелкие кусочки. Эти эксперименты позволяют наглядно продемонстрировать химические свойства данных металлов.
Особый интерес вызывает реакция алюминия с щелочами. При этом образуется сильно щелочная соль алюмината и выделяется водород. Этот процесс является реакцией окисления, при котором алюминий теряет свои электроны и образует положительные ионы. Эксперименты с алюминием и щелочными металлами позволяют также продемонстрировать важное свойство алюминия - его коррозионную стойкость.
Таким образом, изучение взаимодействия металлов с щелочами и щелочноземельными металлами не только позволяет углубить знания о химических свойствах данных элементов, но и подготовить практическую работу, в которой можно наглядно продемонстрировать эти процессы.
Вопрос-ответ
Какие экспериментальные задачи можно решить в химии металлов главных подгрупп?
В химии металлов главных подгрупп можно решать разнообразные задачи, включающие определение ионного состава соединений, выделение металлов из их соединений, изучение реакций металлов с разными веществами и т.д.
Какую практическую работу можно провести по химии металлов главных подгрупп?
В практической работе по химии металлов главных подгрупп можно, например, провести эксперименты по получению и исследованию свойств различных соединений этих металлов, изучить реакции металлов с кислотами или щелочами, провести определение ионного состава соединений и т.д.
Какие методы можно использовать для определения ионного состава соединений металлов главных подгрупп?
Для определения ионного состава соединений металлов главных подгрупп можно использовать различные методы, такие как метод комплексонометрии, метод фотометрии, метод волчьего глаза и другие. Эти методы позволяют определить наличие и концентрацию определенных ионов в растворе.
Какие реакции можно исследовать при работе с металлами главных подгрупп?
При работе с металлами главных подгрупп можно исследовать различные реакции, такие как реакции металлов с кислотами, реакции металлов с основаниями, реакции металлов с солями, реакции образования осадка и т.д. Эти реакции позволяют изучить химические свойства металлов и их соединений.
Можно ли выделить металл из его соединения при проведении экспериментов по химии металлов главных подгрупп?
Да, в экспериментах по химии металлов главных подгрупп можно выделить металл из его соединения. Для этого часто используют реакцию обмена, при которой металл сопрягается с онной соединяющего его иона элемента и выделяется в его чистом металлическом виде.
Как проводить определение металлов в соединениях при работе по химии металлов главных подгрупп?
Для проведения определения металлов в соединениях при работе по химии металлов главных подгрупп используют разные методы. Один из распространенных методов - это метод комплексонометрии, при котором металл сопрягается с комплексоном и образуется стабильный комплекс, что позволяет определить содержание металла в соединении.
