Металлы могут быть использованы в процессе получения водорода путем их реакции с щелочью. Щелочные растворы большинства щелочных металлов, таких как натрий, калий и литий, обладают способностью высвобождать водород при контакте с металлической поверхностью. Эти реакции являются экзотермическими и способны происходить довольно быстро.
Уравнение реакции между металлом и щелочью можно представить в следующем виде:
Металл + Щелочь → Соль + Водород
Например, реакция натрия с гидроксидом натрия выглядит следующим образом:
2Na + 2NaOH → 2Na2O + H2
В результате данной реакции образуется оксид металла и выделяется молекула водорода. Уравнение реакции указывает на количество реагентов и продуктов вещества.
Взаимодействие металлов с щелочью

Взаимодействие металлов с щелочью является одним из методов получения водорода. Щелочь, или гидроксиды щелочных металлов, таких как натрий (NaOH) и калий (KOH), способны реагировать с различными металлами, образуя соответствующие гидроксиды металлов и выделяя водородный газ.
Взаимодействие металлов с щелочью происходит по следующим уравнениям реакций:
- 2Na + 2H2O → 2NaOH + H2
- 2K + 2H2O → 2KOH + H2
В этих реакциях металлы натрий и калий реагируют с молекулами воды, образуя гидроксиды натрия и калия соответственно. При этом выделяется молекулярный водородный газ, который можно использовать в различных процессах.
Взаимодействие металлов с щелочью является эффективным способом получения водорода, так как он происходит быстро и обратимо. Кроме того, данная реакция не требует сложного оборудования и дорогостоящих реагентов, что делает ее доступной и экономически выгодной. Полученный водород можно использовать в различных промышленных процессах, а также в качестве топлива для водородных технологий.
Получение водорода
Водород является одним из самых распространенных элементов во Вселенной и может быть получен различными способами. Один из таких способов - взаимодействие металлов с щелочью.
Первый этап получения водорода путем взаимодействия металлов с щелочью - это растворение металла в щелочи при образовании гидроксидов металлов и выделении водорода. Реакция протекает с выделением большого количества тепла и обычно сопровождается пением и образованием пузырей водорода.
Второй этап заключается в снабжении выделившегося водорода кислородом для его горения. В результате реакции при наличии катализатора (например, платины) водород сгорает, выделяя огонь и воду. Такая реакция важна в промышленности, т.к. водород может быть использован как источник энергии.
Для контроля и защиты от опасностей, связанных с получением водорода, важно соблюдать определенные меры предосторожности. При работе с щелочью и металлами необходимо соблюдать правила личной гигиены и безопасности, использовать защиту глаз и рук, а также работать в хорошо проветриваемом помещении.
Использование полученного водорода в различных областях, таких как производство электроэнергии, производство химических веществ, металлургия и другие, позволяет сократить использование ископаемых ресурсов и снизить негативное воздействие на окружающую среду.
Металлы и реакции
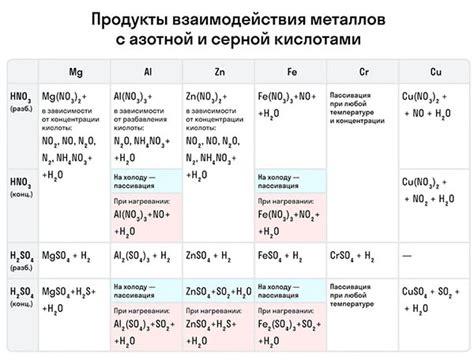
Металлы являются важным классом элементов в химии и физике. Они обладают высокой электропроводностью, теплопроводностью и механической прочностью. Металлы активно участвуют в химических реакциях, образуя сплавы, соли и другие соединения.
Реакции металлов с щелочью являются особенно интересными с точки зрения получения водорода. Металлы, такие как натрий, калий и литий, могут взаимодействовать с щелочами, такими как гидроксид натрия или гидроксид калия, образуя гидроксид металла и выделяя водород.
Уравнение реакции между металлом и щелочью можно записать как:
- Металл + щелочь → гидроксид металла + водород
Например, реакция натрия с гидроксидом натрия может быть записана следующим образом:
- 2Na + 2NaOH → 2Na2O + H2O
Такие реакции играют важную роль в получении водорода, который является чистым и эффективным источником энергии.
| Металл | Щелочь | Гидроксид металла | Водород |
|---|---|---|---|
| Натрий | Гидроксид натрия | Натриевый гидроксид | Выделяется |
| Калий | Гидроксид калия | Калиевый гидроксид | Выделяется |
Взаимодействие металлов с щелочью представляет собой один из многих способов производства и использования водорода в промышленности и научных исследованиях, а также может быть полезным в сфере экологии и энергетики.
Уравнения реакций
Получение водорода путем взаимодействия металлов с щелочью основано на химической реакции, в результате которой образуется водородный газ. При этом происходит непосредственное взаимодействие активного металла с щелочью, в результате чего происходит выделение водорода.
Уравнения реакций, описывающие этот процесс, очень просты. Например, реакция между металлом литием и водой может быть записана следующим образом:
2 Li + 2 H2O → 2 LiOH + H2
В этом уравнении видно, что две молекулы лития взаимодействуют с двумя молекулами воды, образуя две молекулы гидроксида лития (LiOH) и одну молекулу водорода (H2).
Таким же образом можно описать реакции между другими металлами и щелочными растворами. Например, реакция между натрием и водой может быть записана следующим образом:
2 Na + 2 H2O → 2 NaOH + H2
В результате этой реакции образуется две молекулы гидроксида натрия (NaOH) и одна молекула водорода (H2).
Вопрос-ответ
Какие металлы могут использоваться для получения водорода с помощью щелочи?
Для получения водорода с помощью щелочи можно использовать металлы из группы щелочных металлов периодической системы, такие как литий (Li), натрий (Na), калий (K) и др. Реакция этих металлов с водой протекает достаточно интенсивно, приводя к образованию гидроксидов металлов и выделению водорода.
В каких условиях происходит реакция металлов с щелочью для получения водорода?
Реакция металлов с щелочью для получения водорода происходит в присутствии воды. При этом металл реагирует с водой, образуя гидроксид металла и выделяя молекулы водорода. Реакция протекает интенсивно и может быть опасной, поэтому необходимо соблюдать меры предосторожности при проведении таких экспериментов.
Для чего нужен водород, который можно получить путем взаимодействия металлов с щелочью?
Водород, который можно получить путем взаимодействия металлов с щелочью, имеет широкий спектр применений. Водород используется во многих отраслях промышленности, например, в производстве аммиака, водородных топливных элементов, водородных бомб, а также он может использоваться в качестве энергетического носителя. Водород также используется в лабораторных условиях как химический реагент.