Этилен (C2H4) - это органическое соединение, которое состоит из двух атомов углерода и четырех атомов водорода. Он обладает двойной связью между атомами углерода, что делает его очень реакционноспособным. Однако, несмотря на свою химическую активность, этилен не образует соединений с металлами. Это связано с различиями в электроотрицательности и строении металлов и органического соединения.
Металлы, такие как железо, алюминий и медь, обладают отличной проводимостью электричества и тепла. Они имеют кристаллическую структуру, в которой положительно заряженные ионы металла расположены в решетке, а свободные электроны образуют электрический облако вокруг них. Именно эти свободные электроны делают металлы схильными к образованию соединений.
Тогда почему этилен не образует соединений с металлами? Дело в том, что электронная структура этилена и металлов значительно отличается. В этилене, дважды связанные атомы углерода имеют свойство притягивать электроны к себе, образуя положительно заряженные атомы водорода и отрицательно заряженные атомы углерода. В свою очередь, металлы имеют свои свободные электроны, которые могут быть переданы другим атомам для образования соединений.
В результате такого различия в электронной структуре этилена и металлов, этилен не может образовать стабильных связей с металлами. При контакте этилена с металлами, обычно происходит лишь физическое взаимодействие, такое как адсорбция или абсорбция на поверхности металла, но не химическая реакция. Это обусловлено тем, что электронная структура этилена не позволяет ему стабильно принимать или отдавать электроны для образования связей с металлом.
Необходимость связи с атомами водорода
Этилен - это органическое вещество, состоящее из двух атомов углерода и четырех атомов водорода. Однако, почему этилен не образует соединений с металлами? Причина заключается в необходимости связи этилена с атомами водорода.
Металлы, как правило, обладают низкой электроотрицательностью и способны образовывать ионные и ковалентные связи с другими элементами. Однако, этилен, несмотря на наличие двух атомов углерода, имеет несколько особенностей, которые мешают образованию соединений с металлами.
Один из ключевых факторов - это отсутствие в этилене атомов водорода, которые бы могли связываться с атомами металла. Атомы водорода играют важную роль в образовании металлоорганических соединений, так как могут образовывать ковалентные связи с металлами.
Также, этилен обладает специфической структурой, которая затрудняет его способность к образованию соединений с металлами. Углеродные атомы в этилене образуют двойную связь, что делает его структурно их активными для образования соединений. Однако, энергетическая стоимость образования и сохранения связи с атомами углерода в этилене выше, чем энергетическая стоимость образования связи с атомами водорода.
В заключение, отсутствие атомов водорода и специфическая структура этилена делают его малоактивным для образования соединений с металлами. Таким образом, в области химии металлов этилен не является распространенным или важным соединением.
Отсутствие активных электронных пар
Рассматривая вопрос о том, почему этилен не образует соединений с металлами, можно отметить, что одной из главных причин является отсутствие активных электронных пар в его молекуле. Этилен представляет собой углеводород, состоящий из двух углеродных атомов и четырех водородных атомов, связанных между собой двойной связью.
Активные электронные пары представляют собой незанятые электронные орбитали, которые могут участвовать в образовании химических связей с другими атомами или молекулами. В молекуле этилена обе электронные пары, принадлежащие углеродным атомам, используются для образования двойной связи и заняты. Таким образом, молекула этилена не имеет доступных электронных пар для образования связей с металлами.
Металлы обладают способностью образовывать ионные или ковалентные связи с другими веществами, в том числе с органическими соединениями. Однако, чтобы такая связь была возможна, необходимо наличие активных электронных пар в молекуле органического соединения, с которым металл должен реагировать. В случае этилена, активные электронные пары заняты образованием двойной связи, и поэтому молекула этилена не может образовывать связи с металлами.
Недостаточная полярность C-H связей
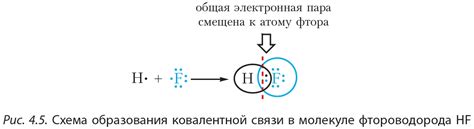
Этилен (C2H4) — безцветный газ с приятным запахом. В химии этанол является несущественным сырьем. Это происходит из-за его особого строения и недостаточной полярности C-H связей.
В этилене электроотрицательность атомов углерода и водорода примерно одинакова. В результате этого связи C-H не являются полярными, то есть не возникает значительного разделения зарядов. Вместо этого этилена характеризует пи-связь между атомами углерода.
Пи-связь обладает особыми свойствами. Во-первых, она более слабая, чем полярная связь, что делает этилен менее реакционноспособным по сравнению с другими молекулярными соединениями. Во-вторых, этилен обладает плоской структурой, что объясняет его способность проявлять свойства ароматических углеводородов.
Из-за недостаточной полярности C-H связей, этилен не способен формировать стабильные комплексные соединения с металлами. Комплексные соединения часто образуются между металлами и соединениями, в которых есть полярные связи, например, между металлом и водой либо алкоголями. В связи с этим, этилен редко используется в качестве лиганда в координационной химии.
Невозможность делиокализации электронов
Этилен, химическое соединение, состоящее из двух углеродных атомов и четырех водородных атомов, не образует соединений с металлами. Одной из причин этого является невозможность делиокализации электронов, которая является ключевым механизмом для образования металлических соединений.
Делиокализация электронов представляет собой процесс, при котором электроны могут свободно перемещаться между атомами, образуя так называемую "электронную область". В металлических соединениях, таких как медь или железо, этот процесс обеспечивает характерные свойства металлов, включая высокую электропроводность и подвижность электронов.
Однако в этилене, представленном малым количеством атомов, электроны не могут свободно перемещаться между ними, так как не существует достаточной электронной области для делиокализации. В результате, этилен не образует металлических соединений с металлами.
Таким образом, отсутствие делиокализации электронов в этилене объясняет его невозможность образования соединений с металлами. Вместо этого, этилен проявляет свои специфические свойства, включая двойную связь между углеродными атомами и реакционную активность в органической химии.
Образование σ-связей
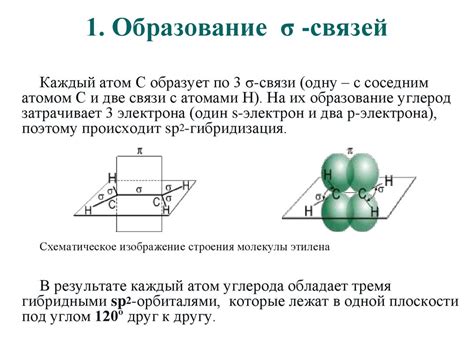
Образование связи между двумя атомами в органических комплексах сопровождается формированием различных типов связей в зависимости от химической природы атомов. Одним из наиболее распространенных типов связей является сигма (σ)-связь. Эта связь формируется между атомами, когда их электронные облака перекрываются и образуют область высокой электронной плотности.
Формирование σ-связей осуществляется путем перекрытия двух атомных орбиталей. Обычно в органических соединениях перекрытие происходит между гибридизованными орбиталями атомов углерода и других атомов, таких как кислород или азот. Гибридизованные орбитали обладают более локализованными электронами и лучше подходят для образования связи.
Образование σ-связей между атомами осуществляется за счет перекрытия орбиталей таким образом, чтобы максимизировать перекрытие электронных облаков. Это позволяет электронам быть более плотно концентрированными вблизи атомов, что обеспечивает более сильные и стабильные связи.
Однако в случае этилена (C2H4) образование σ-связей между металлами и атомами углерода не происходит. Проблема состоит в том, что металлы обладают способностью формировать связи с использованием своих d-орбиталей, которые обладают низкой энергией. Эти d-орбитали не совместимы с орбиталями атомов углерода, что препятствует образованию σ-связей между этими элементами.
Сопоставление энергетических уровней
Энергетические уровни молекул определяют способность соединяться с другими веществами и образовывать новые соединения. В случае этилена (C2H4) и металлов, энергетические уровни данных веществ не сопоставимы, что приводит к отсутствию образования соединений между ними.
Этилен, будучи несовершенной пи-системой, обладает плоской молекулярной структурой, что сказывается на энергетических уровнях. Углеродные атомы в молекуле этилена обладают энергетическими уровнями пи-электронов, которые не являются достаточно высокими для образования сильной химической связи с металлами.
Металлы, в свою очередь, имеют низкие энергетические уровни, связанные с их электронной структурой. Эти энергетические уровни достаточно низкие, чтобы образовать сильные химические связи с другими веществами, но они не сопоставимы с энергетическими уровнями пи-электронов этилена.
Таким образом, различные энергетические уровни этилена и металлов не позволяют образовывать сильные химические связи между ними. Это объясняет отсутствие образования соединений этилена с металлами и его низкую реакционную способность в этом отношении.
Подведение итогов

Таким образом, можно сделать вывод, что этилен, по своей природе, не образует соединений с металлами.
Причина этого заключается в том, что молекула этилена состоит только из атомов углерода и водорода, не содержащих металлических ионов.
Отсутствие металлических ионов в соединении делает его неспособным к образованию химических связей с металлами, так как для формирования таких связей необходимо наличие электронов металлического происхождения.
Это объясняет, почему этилен не реагирует с металлами, не образуя соединений.
Вопрос-ответ
Может ли этилен образовывать соединения с металлами?
Нет, этилен не может образовывать соединения с металлами.
Почему этилен не обладает свойством образовывать соединения с металлами?
Этилен не образует соединения с металлами из-за своей молекулярной структуры и химических свойств.
Какие свойства этилена не позволяют ему образовывать соединения с металлами?
Молекулярная структура этилена не позволяет образовывать стабильные комплексные соединения с металлами.
Может ли этилен образовывать координационные связи с металлами?
Нет, этилен не может образовывать координационные связи с металлами из-за особенностей своей структуры и взаимодействия с металлами.
Какие факторы определяют невозможность образования соединений этилена с металлами?
Невозможность образования соединений этилена с металлами обусловлена как структурными особенностями этилена, так и химическими свойствами металлов.
