Металлы Ca, Mg и Ba относятся к группе щелочноземельных металлов, которые имеют сходную структуру атомов. Все эти металлы имеют атомные номера, соответственно, 20, 12 и 56, и расположены во втором и третьем периодах периодической системы.
Атомы этих металлов имеют общую оболочку электронов, состоящую из двух энергетических уровней - 2s и 2p. Это обусловлено тем, что атомы щелочноземельных металлов имеют два электрона в своей внешней энергетической оболочке. Таким образом, они могут образовывать ионы с положительным зарядом, отдавая эти два электрона и приобретая полную валентность.
Кроме того, структура атомов Ca, Mg и Ba включает также внутренние энергетические уровни, образованные электронами на энергетических оболочках (номерами) 1 и 2. Распределение электронов на этих уровнях обеспечивает стабильность структуры атома и его электронной конфигурации.
Таким образом, структура атомов металлов Ca, Mg и Ba имеет сходное количество заполненных энергетических уровней, что обусловливает их схожие химические свойства и способность образовывать ионы с положительным зарядом.
Структура атомов металлов Ca, Mg, Ba: одинаковое количество заполненных энергетических уровней
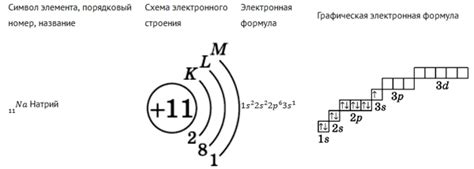
Металлы кальций (Ca), магний (Mg) и барий (Ba) входят в группу алкалиноземельных металлов, и их атомы имеют сходную структуру. Одним из основных признаков структуры атома является количество заполненных энергетических уровней.
Каждый атом металла Ca, Mg и Ba имеет 2 электрона на первом энергетическом уровне, которые находятся в ближайшей к ядру орбитали - s-орбитали. Этот энергетический уровень полностью заполнен и является самым близким к ядру.
На втором энергетическом уровне у атомов этих металлов также находятся 8 электронов, которые заполняют орбитали s- и p-типа. Орбиталь s-типа на втором энергетическом уровне также полностью заполнена, а орбиталь p-типа содержит 6 электронов. В результате, второй энергетический уровень атома металла Ca, Mg и Ba полностью заполнен.
Таким образом, структура атомов металлов Ca, Mg и Ba характеризуется одинаковым количеством заполненных энергетических уровней - первым и вторым. Это объясняет их химические свойства и взаимодействие с другими элементами. Зная структуру атомов этих металлов, можно предсказывать их способность образовывать ионы и вещества с определенными химическими свойствами.
Атомы металлов Ca, Mg, Ba: общая черта в строении
Атомы металлов Ca, Mg и Ba обладают общей чертой в своей структуре - у них сходное количество заполненных энергетических уровней. Это означает, что эти металлы имеют схожую электронную конфигурацию, что важно для их химических свойств и поведения в различных реакциях.
Например, кальций (Ca) имеет электронную конфигурацию [2, 8, 8, 2], что означает, что у него внешний энергетический уровень заполнен двумя электронами. Атом магния (Mg) имеет электронную конфигурацию [2, 8, 2], а барий (Ba) - [2, 8, 18, 8, 2]. Таким образом, и у магния, и у бария внешний энергетический уровень также заполнен двумя электронами.
Это сходство в электронной конфигурации влияет на химические свойства этих металлов. Например, они имеют склонность образовывать ионные соединения, в которых они отдают два электрона, чтобы достичь полной заполненности на своем внешнем энергетическом уровне.
Также, сходная электронная конфигурация делает атомы кальция, магния и бария похожими во многих других аспектах, таких, как их физические свойства и реакционная способность. Эти металлы имеют сходную плотность, температуру плавления и кипения, а также подобные свойства в химических реакциях с другими веществами.
Заполненные энергетические уровни в атомах металлов Ca, Mg, Ba
Атомы металлов Ca, Mg и Ba обладают сходным количеством заполненных энергетических уровней. Заполненность этих уровней определяется количеством электронов в энергетической оболочке атома.
Атом кальция (Ca) имеет 20 электронов, распределенных по энергетическим уровням: 2 электрона на первом уровне, 8 электронов на втором уровне и 8 электронов на третьем уровне. Таким образом, все энергетические уровни до третьего уровня включительно заполнены.
Атом магния (Mg) содержит 12 электронов. Первые два электрона находятся на первом энергетическом уровне, следующие восемь электронов заполняют второй уровень, а оставшиеся два электрона занимают третий уровень. Также, все энергетические уровни до третьего включительно заполнены.
Атом бария (Ba) имеет 56 электронов. Первые два электрона расположены на первом энергетическом уровне, следующие восемь на втором, восемнадцать на третьем, а оставшиеся 28 электронов заполняют четвертый энергетический уровень. Также, все энергетические уровни до четвертого включительно заполнены.
Сходное количество заполненных энергетических уровней в атомах металлов Ca, Mg, Ba говорит о схожей структуре и распределении электронов в их энергетических оболочках. Это является общим свойством элементов, расположенных в одной группе периодической системы.
Структура атомов металлов Ca, Mg, Ba: значимость в химических реакциях
Структура атомов металлов Ca, Mg, Ba характеризуется сходным количеством заполненных энергетических уровней, что оказывает значимое влияние на их химические свойства и реакционную способность.
Заполнение энергетических уровней в атоме металлов является основой для формирования ионов и участвует во многих химических реакциях. Кальций (Ca), магний (Mg) и барий (Ba) имеют одну общую черту - все они находятся во второй группе периодической системы Менделеева и имеют два электрона на внешнем энергетическом уровне. Это делает их склонными к образованию положительно заряженных ионов, что является основой для многих химических реакций.
Подобная структура атомов металлов Ca, Mg, Ba позволяет им образовывать ионы с положительной зарядом +2. Эти ионы легко участвуют в реакциях с отрицательно заряженными анионами, такими как оксиды, гидроксиды и хлориды. Крахмальная энергия этих металлов позволяет им реагировать со многими веществами, образуя соединения с различными элементами и группами, играя важную роль во многих химических реакциях.
Из-за своей структуры и химической реактивности, металлы Ca, Mg, Ba широко используются в различных отраслях, таких как металлургия, строительство, медицина и т.д. Их способность образовывать стабильные соединения и участвовать в химических реакциях делает их незаменимыми компонентами многих важных процессов и материалов в нашей жизни.
Вопрос-ответ
Почему структура атомов металлов Ca, Mg, Ba имеет сходное количество заполненных энергетических уровней?
Сходное количество заполненных энергетических уровней у атомов металлов Ca, Mg, Ba объясняется их расположением в периодической таблице элементов. Эти элементы относятся к группе 2 периодической системы Д.И. Менделеева и имеют по два электрона на s-орбитали своей внешней энергетической оболочки. Это делает их электронную конфигурацию сходной и позволяет им образовывать сходные химические соединения и обладать сходными химическими свойствами.
Какова структура атомов металлов Ca, Mg, Ba?
Атомы металлов Ca, Mg, Ba имеют структуру сравнительно простого уровня электронов. У этих элементов внешний уровень заполнен двумя электронами на s-орбиталях. Уровни электронов в атомах этих металлов заполняются в следующем порядке: 1s^2, 2s^2, 2p^6, 3s^2, 3p^6. Всего на энергетических уровнях металлов Ca, Mg, Ba заполнено 8 электронов.
Чем обусловлена сходная структура атомов металлов Ca, Mg, Ba?
Сходную структуру атомов металлов Ca (кальция), Mg (магния) и Ba (бария) обусловливает их расположение в периодической системе элементов. Эти элементы находятся в одной группе (2 группа) и имеют одинаковое количество валентных электронов, а именно – два. В силу этого, атомы этих металлов имеют аналогичную электронную конфигурацию и сходные химические свойства.
Какое количество энергетических уровней заполнено у атомов металлов Ca, Mg, Ba?
У атомов металлов Ca (кальция), Mg (магния) и Ba (бария) заполнено одинаковое количество энергетических уровней. Эти металлы принадлежат к 2 периоду и каждый атом имеет заполненные энергетические уровни 1s, 2s и 2p. Таким образом, в атомах всех этих металлов заполнено 2 энергетических уровня.

