Металлы являются одним из наиболее известных и широко используемых материалов в нашей жизни. Однако, несмотря на их повсеместную распространенность, мало кто задумывается о причинах их высокой плотности. Почему металлы обладают такими уникальными физическими свойствами? Ответ на этот вопрос кроется в химических связях, которые образуются между атомами металлов.
Основной тип химической связи, присущей металлам, называется металлической связью. Она характеризуется наличием свободно движущихся электронов, которые создают сильные привлекательные силы между атомами металла. Это объясняет высокую плотность металлов и их способность проводить электрический ток.
В отличие от других типов химических связей, таких как ионные и ковалентные, металлическая связь предполагает общий пул свободных электронов, которые могут перемещаться между атомами металла. Это обеспечивает металлам способность проводить электрический ток, а также придает им особенную механическую прочность и возможность быть изготовленными в различные формы и конструкции.
Плотность металлов является результатом не только металлической связи, но и других факторов, таких как размер и форма атомов, степень упаковки и наличие других элементов. Проникнуть в тайны плотности металлов помогает не только углубленное изучение их химических связей, но и позволяет создавать новые материалы с определенными физическими свойствами для различных областей применения.
Плотность металлов: как образуются химические связи?

Образование химических связей в металлах является важной частью понимания их структуры и свойств. Химические связи в металлах основаны на особом типе взаимодействия, называемом металлической связью.
Металлическая связь возникает из-за способности атомов металла образовывать ионные решетки. Атомы металла отдают свои внешние электроны в общий электронный облако, что создает положительно заряженные ионы металла и свободные электроны.
Эти свободные электроны могут свободно двигаться по материалу, создавая электрический ток и имея важное значение для электропроводности металлов. Они также обладают большой подвижностью и позволяют металлам быть хорошими проводниками тепла.
Металлическая связь также определяет плотность металлов. Поскольку свободные электроны занимают относительно большой объем, они создают металлическую сеть с низкой плотностью. В то же время, присутствие положительно заряженных ионов металла напрямую влияет на структуру и плотность металлической сетки.
Таким образом, химические связи в металлах образуются за счет взаимодействия атомов металла через электронный облако. Металлическая связь определяет структуру металлов, их свойства и плотность.
Структура атомов металлов
Металлы - это группа химических элементов, которые обладают характеристиками, такими как высокая электропроводность и теплопроводность, пластичность и относительно высокая плотность. Эти свойства металлов связаны с их особой структурой атомов.
Атомы металлов имеют сложную структуру, состоящую из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, а вокруг него движутся электроны. Однако, в отличие от неметаллических элементов, у металлов электронная оболочка частично заполнена электронами, что делает их более стабильными и способными к формированию металлической связи.
Металлическая связь возникает благодаря специфической структуре атомов металла. Внутри кристаллической решетки металла атомы располагаются в регулярных интервалах и образуют кристаллическую решетку. При этом, электроны внешней оболочки атомов металла свободно перемещаются по всей решетке, создавая так называемый "море электронов". Это море электронов обеспечивает характеристики металлов, такие как электропроводность и теплопроводность.
Структура атомов металлов также влияет на их плотность. Поскольку атомы металла располагаются в регулярных интервалах внутри кристаллической решетки, они могут компактно упаковываться друг к другу. Это позволяет металлам иметь высокую плотность и обеспечивает их прочность и твердость.
Плотность металлической решетки
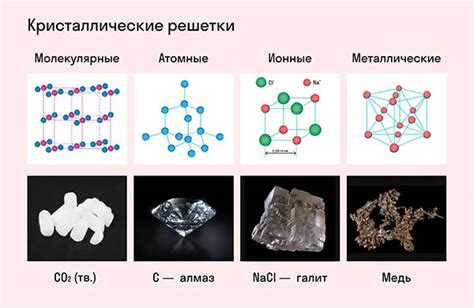
Плотность металлической решетки является одним из важных характеристик металлов. Она определяет, насколько плотно атомы металла расположены в кристаллической решетке. Плотность металлической решетки измеряется в единицах массы, таких как г/см³ или кг/м³.
Металлическая решетка образуется за счет особой структуры, в которой атомы металла расположены в регулярных многослойных плоскостях. Атомы в каждом слое тесно связаны между собой благодаря химическим связям, что обеспечивает прочность и устойчивость металла.
Плотность металлической решетки зависит от нескольких факторов, включая массу атомов металла, их размеры и количество атомов в единице объема. Чем больше масса атомов и их количество, тем более плотная решетка образуется, и, соответственно, выше плотность металла.
Также плотность металлической решетки может зависеть от примесей и легирующих элементов, которые могут изменять структуру и свойства металла. Изменение плотности металла может влиять на его физические и механические свойства, такие как твердость, прочность и пластичность.
Важно отметить, что плотность металлической решетки не является постоянной величиной и может изменяться в зависимости от условий и методов получения металла. Также плотность металлической решетки может использоваться для идентификации металла и его сортамента, а также для расчетов и проектирования различных конструкций и изделий из металла.
Межатомные взаимодействия как основа связи
Плотность металлов объясняется особыми свойствами их химической связи, которая определяется межатомными взаимодействиями. Эти взаимодействия возникают из-за притяжения между заряженными частицами, такими как электроны и ядра атомов.
Основным типом межатомных взаимодействий является электромагнитная сила. Электроны, которые обращаются вокруг ядер, создают электрическое поле. Это поле притягивает ядра других атомов, что обеспечивает их скопление в твердом состоянии.
Кроме того, межатомные взаимодействия также могут быть обусловлены делокализацией электронов в металлах. Электроны в металлах могут двигаться свободно внутри кристаллической решетки, создавая так называемое "море электронов". Это "море" обеспечивает металлам их хорошую электропроводность и высокую плотность.
Методы межатомных взаимодействий между атомами в металлах сложны и включают в себя такие параметры, как электростатическое притяжение, межатомные связи и ковалентные связи. Все эти факторы совместно обеспечивают высокую плотность металлов и их хорошие физические свойства.
Влияние веществ на плотность металла
Плотность металла – это характеристика, определяющая массу единицы объема материала. Она зависит от множества факторов, включая состав металла и его структуру.
Вещества, добавляемые в металл при его производстве, могут значительно влиять на его плотность. Например, при сплавлении металла с другими материалами, образуется сплав, в котором можно изменять плотность путем изменения пропорций компонентов. Использование различных добавок, таких как сплавы других металлов или неметаллические элементы, позволяет создавать металлы с разными плотностями.
Изменение плотности металла также может быть связано с изменением его кристаллической структуры. Некоторые вещества, такие как легирующие элементы или примеси, могут встраиваться в кристаллическую решетку металла, изменяя расстояния между атомами и, следовательно, влияя на его плотность.
Кроме того, воздействие различных веществ на металл может происходить на уровне атома. Взаимодействие атомов металла с атомами других элементов может изменять электронную структуру металла, что, в свою очередь, влияет на его плотность.
Таким образом, выбор веществ, добавляемых в металл, может оказывать существенное влияние на его плотность. Понимание этой зависимости позволяет контролировать процессы производства металла и создавать материалы с определенными свойствами, включая необходимую плотность. Ведь плотность металла имеет важное значение для его применения в различных областях, от авиации до электроники и медицины.
Эффекты на поверхности металла
На поверхности металла происходят различные эффекты, которые могут влиять на его свойства. Один из таких эффектов – окисление, которое приводит к образованию оксидной пленки на поверхности металла. Эта пленка может защищать металл от коррозии, однако при длительном воздействии окружающей среды может стать причиной деградации металла и потери его свойств.
Другой эффект на поверхности металла – образование адсорбционных слоев. Эти слои образуются в результате взаимодействия металла с атмосферными газами или жидкостями. Адсорбционные слои могут изменять электрохимические свойства металла и способствовать его окислению или коррозии.
Еще одним эффектом, который влияет на поверхность металла, является растрескивание. Растрескивание – это образование мелких трещин или сколов на поверхности металла. Оно может быть вызвано различными факторами, такими как вибрация, термические циклы или неравномерное напряжение внутри металла. Растрескивание может снизить прочность и долговечность металла.
Также на поверхность металла может влиять эффект катодной и анодной окраски. Этот эффект проявляется в том, что на поверхности металла образуются участки с различной окраской. Катодная окраска характеризуется образованием более темных или черных участков, а анодная окраска – более светлых или белых.
Взаимодействие металлов с другими элементами
Металлы - это элементы, которые в основном обладают блестящим, твердым и проводящим электричество свойством. Они способны вступать во взаимодействие с другими элементами, образуя различные химические соединения.
Взаимодействие металлов с неметаллами. Металлы способны образовывать ионные или ковалентные соединения с неметаллами. В ионных соединениях металлы образуют катионы, отдавая электроны, а неметаллы образуют анионы, принимая электроны. Примеры таких соединений - хлорид натрия (NaCl) и оксид алюминия (Al2O3). В ковалентных соединениях металлы образуют с неметаллами совместно используемые электроны. Примером такого соединения является молекула воды (H2O), где металл водород формирует ковалентную связь с неметаллом кислородом.
Взаимодействие металлов с другими металлами. Металлы также могут взаимодействовать друг с другом, образуя сплавы. Сплавы являются материалами, которые состоят из двух и более металлов. Взаимодействие металлов может происходить путем образования твердого раствора, где атомы одного металла замещают атомы другого металла в кристаллической решетке. Примерами сплавов являются бронзы (медь и олово) и нержавеющая сталь (железо, хром и никель).
Взаимодействие металлов с кислородом. Многие металлы имеют способность взаимодействовать с кислородом, образуя оксиды. Это происходит путем передачи электронов от металла к кислороду. Примерами оксидов являются оксид железа (Fe2O3) и оксид алюминия (Al2O3). Взаимодействие металлов с кислородом может привести к образованию пассивной пленки на поверхности металла, которая защищает его от дальнейшей коррозии.
Таким образом, взаимодействие металлов с другими элементами позволяет получить разнообразные химические соединения и материалы с различными свойствами и применениями.
Выводы
Исследование плотности металлов позволяет получить ценную информацию о их химических связях. Из данных экспериментов следует, что плотность металлов обычно высокая, что связано с компактной упаковкой атомов в кристаллической решетке. Это объясняется наличием сильных металлических связей, которые обеспечивают высокую степень упорядоченности и стабильность металлической структуры.
Изучение химической связи в металлах также подтверждает, что наиболее плотные металлы обладают самой прочной связью, так как в них электроны свободно передвигаются по кристаллической решетке. Это объясняется наличием делящихся электронов, образующих так называемые свободные электроны. Они обеспечивают химическую связь и металлические свойства металлов, такие как хорошая электропроводность и теплоотдача.
Исследование плотности металлов также помогает установить связь между структурой и свойствами материала. Металлические связи влияют на механические и физические свойства металлов, такие как твердость, пластичность и плавление. Например, металлы с более плотной кристаллической решеткой обычно обладают высокой твердостью и точкой плавления.
В целом, изучение плотности металлов и химических связей является важным шагом в понимании структуры и свойств металлических материалов. Эти знания имеют практическую значимость и могут быть использованы в различных областях, таких как материаловедение, производство, металлообработка и технологии.
Вопрос-ответ
Что такое плотность металлов?
Плотность металлов — это мера массы, занимаемой единицей объема материала. Она показывает, насколько тяжелый и компактный металл, и выражается в г/см³ или кг/м³.
Какие факторы влияют на плотность металлов?
Плотность металлов зависит от числа атомов в единице объема и массы каждого атома. Влияют также структура решетки, степень упакованности атомов и их межатомные расстояния.
Почему некоторые металлы имеют высокую плотность?
Высокую плотность металлов обуславливают их химические связи между атомами. Эти связи обладают высокой прочностью и способностью выдерживать большие нагрузки, поэтому металлы могут быть очень плотными.
Какая связь между химическими связями и плотностью металлов?
Химические связи в металлах обуславливают их упаковку атомов и структуру решетки, что имеет прямое отношение к плотности материала. Чем более плотно упакованы атомы, тем выше плотность металла.
Какие металлы имеют самую высокую плотность?
Самую высокую плотность имеют такие металлы, как иридий, осмий и платина. Причина высокой плотности этих металлов заключается в их упаковке атомов, которая обеспечивается особыми химическими связями.
