Плавиковая кислота, также известная как гидрофторная кислота или водородный фторид, является одной из самых сильных кислот. Ее химическая формула HF указывает на наличие одной молекулы фтора и одной молекулы водорода. Эта кислота является безцветной жидкостью, которая обладает ядовитыми свойствами и может вызывать серьезные ожоги при контакте с кожей.
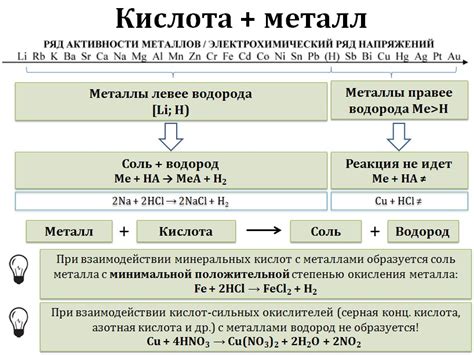
При взаимодействии плавиковой кислоты с различными металлами происходят химические реакции, которые могут иметь различные последствия. Металлы, такие как алюминий, цинк, магний и железо, реагируют с HF, образуя соли и выделяя гидроген. Эти реакции могут быть очень интенсивными, с выделением большого количества пузырьков и тепла.
Однако некоторые металлы, такие как золото и платина, не реагируют с плавиковой кислотой. Это связано с их инертностью и невосприимчивостью к химическим реакциям. Такие металлы могут использоваться в качестве защитных покрытий или элементов, устойчивых к агрессивным веществам, включая плавиковую кислоту.
Важно отметить, что плавиковая кислота является опасным химическим соединением и требует осторожного обращения. При работе с ней необходимо соблюдать все практики безопасности и использовать соответствующие защитные средства. Правильное понимание реакции плавиковой кислоты с различными металлами позволяет эффективно использовать ее в лабораторных и промышленных процессах.
Реакция плавиковой кислоты с металлами:

Плавиковая кислота, или хлористоводородная кислота, является одним из самых активных кислотных соединений, и ее реакция с различными металлами является достаточно глубоко изученным явлением. Реакции плавиковой кислоты с металлами происходят по типу образования солей и выделения водорода.
Например, при взаимодействии плавиковой кислоты с непригоршней металла, таких как натрий или калий, образуются соответствующие соли хлористого натрия и хлористого калия, а также выделяется водородный газ. При этом реакция идет довольно интенсивно, с выделением тепла и образованием пенящегося раствора.
Однако, не все металлы реагируют с плавиковой кислотой одинаково интенсивно. Например, неактивные металлы, такие как золото или платина, практически не реагируют с плавиковой кислотой, поскольку их поверхность защищена оксидным пленочным слоем. Активные металлы, например, цинк или железо, реагируют очень быстро, выделяя значительное количество водорода.
Реакция между плавиковой кислотой и металлами является одним из примеров окислительно-восстановительных реакций. Кислота в данном случае действует в качестве окислителя, укорачиваясь на электроны, а металл - в качестве восстановителя, увеличивая свой степень окисления. В результате этой реакции образуются ионы металла и ионы водорода.
Таким образом, реакция плавиковой кислоты с различными металлами является активным и динамичным процессом, который может быть использован в промышленности для получения соответствующих солей и выделения водорода.
Физические свойства металлов
Металлы обладают рядом особых физических свойств, которые делают их уникальными и широко используемыми в различных областях нашей жизни.
Одним из главных физических свойств металлов является их высокая тепло- и электропроводность. Именно благодаря этим свойствам металлы являются отличными проводниками тепла и электричества. Видным примером является использование металлов для создания проводов и электронных компонентов. Благодаря своей структуре и наличию свободно двигающихся электронов, металлы обладают способностью передавать энергию очень эффективно.
Еще одним важным физическим свойством металлов является их высокая пластичность и деформируемость. Металлы способны изменять свою форму, не ломаясь или разрушаясь. Это позволяет легко создавать их различные конструкции и изделия методом холодной и горячей обработки. Ковка, прокатка, вытяжка и другие технологии позволяют создавать металлические изделия различных форм и размеров.
Металлы также обладают высокой плотностью, что означает, что они имеют большую массу в соотношении к своему объему. Благодаря этому физическому свойству металлы обладают высокой прочностью и жесткостью, что делает их очень устойчивыми к механическим нагрузкам. Именно поэтому металлы широко применяются в строительстве, машиностроении и промышленности, где требуется высокая прочность материала.
В заключение, физические свойства металлов, такие как высокая тепло- и электропроводность, пластичность, деформируемость и прочность, делают их незаменимыми в различных отраслях промышленности и научных исследований. Благодаря своей уникальной природе, металлы играют важную роль в создании современного мира.
Структура плавиковой кислоты

Плавиковая кислота, также известная как карбоксиловая кислота, имеет общую формулу R-COOH, где R представляет собой углеводородный остаток. Эта кислота является одной из основных классов органических соединений и встречается в природе в различных формах и сочетаниях. Ее структура состоит из карбонильной группы (C=O) и гидроксильной группы (OH), связанных с одним атомом углерода.
Карбонильная группа является функциональной группой, которая состоит из двойной связи между атомами углерода и кислорода. Гидроксильная группа представляет собой группу, содержащую один атом кислорода и один атом водорода, связанные с углеродным атомом. Эти две группы образуют основу структуры плавиковой кислоты.
Структура плавиковой кислоты может быть изменена путем введения различных функциональных групп в углеводородный остаток R. Например, если R представляет собой метиловый остаток (-CH3), то соединение называется метановой кислотой (H-COOH). Если R содержит более одной карбонильной группы, то соединение называется дикислотой. Эта вариативность в структуре позволяет плавиковой кислоте обладать разнообразными химическими свойствами и использоваться во многих областях науки и промышленности.
Реакция плавиковой кислоты с щелочными металлами
Плавиковая кислота (HF) является одной из самых коррозионно-активных кислот. Она способна образовывать агрессивный газ фторид водорода (HF), который обладает высокой токсичностью и может вызвать серьезные ожоги.
Щелочные металлы - это элементы группы 1 периодической системы, такие как литий (Li), натрий (Na), калий (K) и др. Они характеризуются низкой электроотрицательностью и образуют ионы, обладающие положительным зарядом, когда реагируют с плавиковой кислотой.
Реакция плавиковой кислоты с щелочными металлами приводит к образованию солей, содержащих ион фторида (F-) и ион металла. Например, реакция с натрием может быть представлена следующим уравнением:
2 HF + 2 Na → 2 NaF + H2
Процесс реакции можно представить с помощью схемы:
- Молекулы плавиковой кислоты (HF) взаимодействуют с ионами натрия (Na+) щелочного металла.
- Происходит обмен ионами, при котором ионы фторида (F-) замещают ионы гидроксила (OH-) в составе натрия, образуя ион фторида (NaF).
- В результате образуется соль плавиковой кислоты (NaF) и высвобождается молекула воды (H2O).
Реакция плавиковой кислоты с щелочными металлами является экзотермической, то есть при ее протекании выделяется тепло.
Понимание химических свойств плавиковой кислоты и щелочных металлов является важным для безопасной работы с этими веществами и предотвращения возможных аварийных ситуаций.
Плавиковая кислота и реакция с щелочноземельными металлами

Щелочноземельные металлы в периодической таблице элементов располагаются во второй группе. Эти металлы включают в себя бериллий, магний, кальций, стронций, барий и радий. Реакция плавиковой кислоты с щелочноземельными металлами является одной из важных химических реакций, которая часто используется для получения различных соединений и солей щелочноземельных металлов.
Плавиковая кислота (HF) является слабой известной кислотой, которая обладает сильными коррозионными свойствами. Она образуется в результате реакции газообразного фтора с водой или влажными окислами фтора. Взаимодействие щелочноземельных металлов с плавиковой кислотой происходит с образованием солей металлов и выделением газообразного фторида.
Во время реакции плавиковой кислоты с щелочноземельными металлами, например, магнием (Mg), образуется соль магниевого фторида (MgF2). Реакция происходит по следующей схеме: 2HF + Mg → MgF2 + H2. Как видно из уравнения реакции, водород выделяется в результате реакции и избыток плавиковой кислоты окисляет магний до искородной магнезии.
Реакция плавиковой кислоты с щелочноземельными металлами также может протекать с образованием комплексных соединений, например, таких как гидроксид бария (Ba(OH)2). Эти реакции обладают значительным практическим значением и используются для получения соединений щелочноземельных металлов в химической промышленности и лабораторных условиях.
Взаимодействие плавиковой кислоты с тяжелыми металлами
Плавиковая кислота, также известная как фторид водорода или HF, представляет собой одну из самых сильных кислот. У нее высокая реакционная способность, особенно когда дело касается взаимодействия с тяжелыми металлами.
При контакте с тяжелыми металлами, такими как свинец, кадмий, ртуть или уран, плавиковая кислота вызывает серьезные химические реакции и образует соответствующие соли металлов. Это связано с их высокой электронной дорогой, что позволяет им эффективно взаимодействовать с агрессивной средой плавиковой кислоты.
Во время взаимодействия плавиковой кислоты с тяжелыми металлами, возникает выделение газа — фтороводорода. Этот газ имеет резкий запах и сильно коррозионен, что делает взаимодействие опасным и требующим особых мер предосторожности.
Взаимодействие плавиковой кислоты с тяжелыми металлами может привести к различным реакциям, включая образование фторидов металлов. Эти реакции часто используются в химическом производстве и лабораторных исследованиях для получения нужных соединений и оценки характеристик тяжелых металлов.
Как плавиковая кислота взаимодействует с легкими металлами
Плавиковая кислота, также известная как фтористоводородная кислота, образуется при взаимодействии воды с газообразным фтором. Эта кислота обладает сильными коррозионными свойствами и может реагировать с различными металлами, включая легкие металлы.
Легкие металлы, такие как алюминий, магний и литий, являются активными металлами, которые легко взаимодействуют с плавиковой кислотой. При контакте с плавиковой кислотой эти металлы мгновенно растворяются, образуя фториды металлов и выделяя водородный газ.
Реакция плавиковой кислоты с легкими металлами происходит очень быстро и сопровождается выделением теплоты и пузырьков газа. В результате этой реакции образуются довольно стабильные фториды металлов, которые имеют высокую температуру плавления и представляют собой прочные соединения.
Плавиковая кислота может быть использована для очистки поверхности легких металлов от оксидных слоев. При взаимодействии с плавиковой кислотой оксиды металлов превращаются в легко удаляемые фториды металлов. Этот процесс позволяет улучшить адгезию между металлом и окружающей средой, что может быть полезно при проведении различных металлургических и электрохимических процессов.
Все вышеуказанные факты подтверждают, что плавиковая кислота эффективно взаимодействует с легкими металлами, оказывая на них коррозионное воздействие и способствуя формированию стабильных соединений. Это делает плавиковую кислоту важным инструментом в области металлургии и других отраслях, где требуется обрабатывать поверхность легких металлов.
Влияние структуры металлов на реакцию с плавиковой кислотой
Плавиковая кислота, или HF, является одним из наиболее коррозионно-активных веществ и может образовывать стабильные соединения с множеством металлов. Однако, реакция HF с различными металлами зависит от их структуры, включая кристаллическое строение и элементный состав.
Прежде всего, следует отметить, что плавиковая кислота может действовать на металлы как в жидком, так и в газообразном состоянии. В случае жидкой формы, HF способна разрушать пассивную оксидную пленку, которая обычно образуется на поверхности металла и служит защитным слоем. Это позволяет кислоте взаимодействовать с металлической структурой, разрушая ее и образуя новые соединения.
Структура металла влияет на реакцию с плавиковой кислотой благодаря различным факторам. Во-первых, кристаллическая структура металла определяет доступность элементов для взаимодействия с кислотой. Если металл имеет компактную структуру, кислота сможет легче проникнуть во внутренние слои металла и вызвать образование новых соединений.
Во-вторых, элементный состав металла также оказывает влияние на реакцию с плавиковой кислотой. Некоторые металлы могут образовывать стойкие соединения с кислотой и не подвергаться ее коррозии, благодаря образованию пассивной пленки из соответствующих оксидов или фторидов.
Таким образом, структура металлов, включая их кристаллическое строение и элементный состав, являются важными факторами, определяющими реакцию с плавиковой кислотой. Изучение этих взаимодействий позволяет предсказывать поведение металлов в различных условиях и разрабатывать новые материалы с улучшенной коррозионной стойкостью.
Вопрос-ответ
Какая реакция происходит между плавиковой кислотой и металлами?
Реакция между плавиковой кислотой и металлами приводит к образованию солей и выделению водорода. Это обычная реакция образования солей, называемая общим названием "реакция металлов с кислотами".
Какие металлы реагируют с плавиковой кислотой?
Многие металлы могут реагировать с плавиковой кислотой. Наиболее активные металлы, такие как натрий (Na), калий (K) и литий (Li), реагируют с плавиковой кислотой безоговорочно. Другие металлы, такие как цинк (Zn), алюминий (Al) и железо (Fe), также могут реагировать с плавиковой кислотой, но требуют некоторых условий, таких как высокая концентрация или повышенная температура.
Как выглядит реакция между плавиковой кислотой и металлом?
Реакция между плавиковой кислотой и металлом происходит следующим образом: металл обладает электронами, которые могут передаваться водороду плавиковой кислоты, образуя ион водорода (H+), который реагирует с образующимся ионом металла, образуя соль. При этом выделяется газ водород (H2).
Какие условия могут влиять на скорость реакции между плавиковой кислотой и металлом?
Скорость реакции между плавиковой кислотой и металлом может зависеть от нескольких условий. Во-первых, концентрация плавиковой кислоты: чем она выше, тем быстрее будет происходить реакция. Во-вторых, температура: при повышенной температуре реакция проходит быстрее. Также влияние может оказывать поверхность металла, его чистота и наличие ингибиторов или катализаторов.
Для чего используется реакция плавиковой кислоты с металлами?
Реакция плавиковой кислоты с металлами может использоваться в различных процессах. Например, она может быть использована для очистки поверхностей металлов от окислов и загрязнений. Также реакция может использоваться в аналитической химии для определения содержания металлов в образцах. Кроме того, полученные соли могут иметь промышленное применение или использоваться в химических реакциях для получения других соединений.