Реакция получения металла Fe2O3 с помощью Al - это одна из наиболее эффективных методов получения железа из оксида железа(III). В результате этой реакции происходит восстановление Fe2O3 металлом Al, что приводит к образованию чистого железа и оксида алюминия (Al2O3). Эта реакция широко используется в металлургической промышленности для получения железа и его соединений.
Уравнение реакции между Fe2O3 и Al выглядит следующим образом:
2 Al + Fe2O3 -> 2 Fe + Al2O3
В результате этой реакции двухатомный алюминий (Al) восстанавливается до элементарного состояния и образует оксид алюминия (Al2O3), а трехатомный оксид железа(III) (Fe2O3) восстанавливается до чистого железа (Fe).
Особенностью этой реакции является высокая эффективность восстановления железа и возможность получения высококачественного металла. Реакция протекает при высокой температуре, вакууме или при наличии инертного газа, такого как аргон, для исключения окисления металла. Также необходимо контролировать процесс, чтобы избежать непредвиденных реакций или образования легированных составов.
Химическая реакция между металлом железа и оксидом алюминия
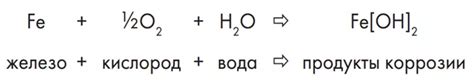
Химическая реакция между металлом железа (Fe) и оксидом алюминия (Al2O3) является одной из важных реакций в химии. Эта реакция является реакцией окисления-восстановления, при которой металл железа восстанавливается, а оксид алюминия окисляется.
Уравнение реакции обычно записывается следующим образом: 2Al + Fe2O3 → 2Fe + Al2O3. В результате данной реакции получается металл железа Fe и оксид алюминия Al2O3.
Реакция между металлом железа и оксидом алюминия имеет ряд особенностей. Во-первых, она сопровождается выделением большого количества тепла. Это объясняется тем, что реакция является экзотермической, то есть освобождается энергия.
Во-вторых, реакция протекает в присутствии кислорода, поэтому важно обеспечить ее проведение в открытой системе или при доступе воздуха. Кислород необходим для окисления металла железа и образования оксида алюминия.
Таким образом, реакция между металлом железа и оксидом алюминия относится к важным реакциям в химии и имеет свои особенности, включая выделение тепла и окислительные свойства оксида алюминия.
Механизм реакции и уравнение химической реакции
Реакция получения металла Fe2O3 с помощью Al происходит по сложному механизму, который можно описать следующими этапами. Сначала алюминий (Al) реагирует с кислородом (O) из оксида железа (Fe2O3), образуя оксид алюминия (Al2O3) и выделяя тепло. Затем, оксид алюминия реагирует с дополнительным количеством алюминия, образуя металлический железо (Fe) и оксид алюминия (Al2O3).
Уравнение химической реакции можно записать следующим образом:
2Al + Fe2O3 → 2Fe + Al2O3
В этом уравнении вещества, участвующие в реакции, записываются слева от стрелки, а получаемые вещества - справа. Коэффициенты перед каждым веществом указывают, в каких соотношениях они вступают в реакцию. В данном случае, 2 молекулы алюминия реагируют с 1 молекулой оксида железа, образуя 2 молекулы металлического железа и 1 молекулу оксида алюминия.
Эта реакция имеет много применений, включая получение металла железа из его оксида в промышленности, а также использование алюминия в качестве редукционного агента. Важно отметить, что реакция происходит с выделением большого количества тепла, что является одной из особенностей данной химической реакции.
Особенности процесса получения металла Fe2O3 с помощью Al

Процесс получения металла Fe2O3 с помощью Al основан на реакции термического разложения оксида железа(III) при взаимодействии с алюминием. Реакция протекает при повышенных температурах и позволяет получить чистый металлический железо, который затем может быть использован в различных отраслях промышленности.
Особенностью данного процесса является возможность получения металлического железа с высокой степенью чистоты. В процессе реакции оксид железа(III) Fe2O3 и алюминий Al вступают в химическую связь, при этом оксид железа(III) разлагается на металлическое железо Fe и оксид алюминия Al2O3. Этот процесс особенно полезен при производстве чистого железа, так как он позволяет избежать примесей и загрязнений.
Другой особенностью процесса получения металла Fe2O3 с помощью Al является его энергетическая эффективность. Реакция происходит при высоких температурах, что позволяет существенно сократить время его проведения. Кроме того, эта реакция является самоподогревающейся, то есть, после начала процесса, он продолжается автоматически без дополнительного подогрева.
Интересной особенностью процесса является также его экономическая выгода. Использование алюминия Al взамен других реагентов позволяет снизить затраты на производство металла и упростить технологический процесс. Кроме того, полученное металлическое железо можно повторно использовать при производстве других изделий из железа, что позволяет сократить расходы на его закупку или добычу.
Применение полученного металла и перспективы развития
Полученный металл железа, полученный из реакции Fe2O3 с помощью алюминия, имеет широкий спектр применений в различных отраслях нашей жизни. Он является одним из основных строительных материалов благодаря своим прочным и долговечным свойствам.
Благодаря своей высокой коррозионной стойкости, металл железа активно используется в производстве автомобилей, кораблей и других транспортных средств. Он обладает высокой устойчивостью к агрессивным средам и способен сохранять свои качества на протяжении длительного времени. Благодаря этому, различные металлические конструкции на основе металла железа широко применяются в сфере строительства мостов, зданий и сооружений.
Однако, несмотря на все его преимущества, металл железа имеет недостаток в виде высокой плотности, что делает его тяжелым для некоторых приложений. Именно поэтому сейчас активно проводятся исследования и разработки в области легких и прочных композитных материалов, в которых железо является одной из основных компонент.
Также возможно использование полученного металла железа в энергетических системах, в частности, в производстве солнечных батарей и водородных топливных элементов. Железо может использоваться в качестве катализатора в таких системах, что может значительно улучшить их эффективность и стабильность.
Таким образом, полученный металл железа имеет огромный потенциал для применения в различных отраслях и его дальнейшие исследования и разработки могут привести к созданию новых технологий и материалов, способных улучшить нашу жизнь и сделать ее более устойчивой.
Вопрос-ответ
Какое уравнение реакции получения металла Fe2O3 с помощью Al?
Уравнение реакции выглядит следующим образом: 2Al + Fe2O3 = 2Fe + Al2O3.
Каковы особенности реакции получения металла Fe2O3 с помощью Al?
Одной из особенностей этой реакции является то, что алюминий вытесняет железо из его оксида, что позволяет получить металл Fe из его оксида Fe2O3.
Почему для реакции получения металла Fe2O3 используется алюминий?
Алюминий используется для этой реакции, потому что он более активный металл, чем железо. Активный металл может вытеснять менее активный металл из его оксида, что и происходит в данной реакции.
Какой продукт образуется в результате реакции получения металла Fe2O3 с помощью Al?
В результате этой реакции образуется металлическое железо (Fe) и оксид алюминия (Al2O3).
Как изменяются валентности железа и алюминия в результате реакции?
В результате реакции, валентность железа снижается с +3 до 0, а валентность алюминия повышается с 0 до +3.
Какие условия необходимы для проведения реакции?
Для проведения данной реакции необходимо наличие порошкообразного алюминия и чистого оксида железа (Fe2O3), а также их взаимодействие при высокой температуре.
Какие приложения имеет эта реакция в промышленности или науке?
Эта реакция имеет широкое применение в промышленности, особенно в металлургической отрасли. Полученное металлическое железо (Fe) может использоваться для производства стали, различных металлических изделий и материалов. Также эту реакцию можно использовать в научных исследованиях, например, для изучения оксидационных реакций и свойств металлов.