Электродный потенциал – это величина, характеризующая способность металла отдавать или принимать электроны при контакте с другими веществами. Он определяет, насколько легко происходит окисление или восстановление металла. Обычно все металлы имеют положительное значение электродного потенциала, так как способны отдавать электроны, но некоторые металлы имеют отрицательное значение.
Причина отрицательного электродного потенциала у некоторых металлов связана с их химическими свойствами. Например, металлы, обладающие высокой реакционной способностью, имеют отрицательное значение электродного потенциала. Это связано с тем, что они легко окисляются, т.е. отдают электроны, и при этом образуют ионы с положительным зарядом. В результате такой реакции, электродный потенциал теряет положительное значение и становится отрицательным.
Кроме того, отрицательное значение электродного потенциала может быть связано с наличием других веществ в окружающей среде. Например, в наличии окислителей и кислот могут принимать участие реакции, в результате которых электродный потенциал металла снижается, и он приобретает отрицательное значение. Также, длинные контакты с другими металлами, способствуют образованию гальванических элементов и протеканию электрохимических процессов, что может приводить к изменению электродного потенциала.
Важно отметить, что отрицательное значение электродного потенциала у металлов не является нежелательным свойством. Это просто характеристика их химических свойств и способности взаимодействовать с другими веществами. Кроме того, эти металлы могут использоваться в различных электрохимических процессах, например, при создании элементов гальванических батарей.
Таким образом, отрицательное значение электродного потенциала у некоторых металлов обусловлено их химическими свойствами и взаимодействием с окружающими веществами. Это позволяет им играть важную роль в различных электрохимических процессах и находить свое применение в современных технологиях и промышленности.
Отрицательное значение электродного потенциала некоторых металлов: причины и значение
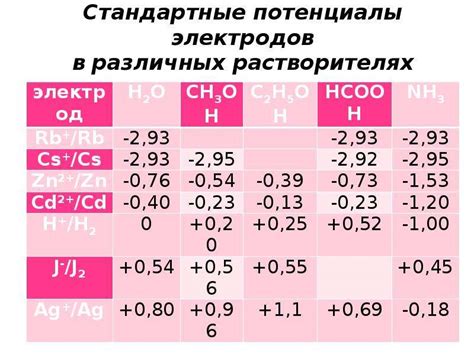
Электродный потенциал металла определяет его способность обращать энергию химической реакции в электрическую. Обычно, электродный потенциал измеряется относительно стандартного водородного электрода (SHE), который имеет значение 0 В. Однако, некоторые металлы, такие как цинк и алюминий, имеют отрицательное значение электродного потенциала.
Причина отрицательного электродного потенциала некоторых металлов заключается в их электрохимической активности и склонности к окислению. Такие металлы имеют большую аффинность к электронам, что делает их электроположительными и способными выделять электроны в химических реакциях. Когда металл находится в контакте с раствором соли или кислотой, происходит реакция окисления металла, в результате которой металл отдает свои электроны раствору. Эти электроны движутся через внешнюю электрическую цепь, создавая электрический ток.
Отрицательное значение электродного потенциала у некоторых металлов указывает, что они обладают большей способностью терять электроны и окисляться по сравнению с водородом. Это имеет важное значение в контексте коррозии и сохранения металлических конструкций. Например, используемые для защиты конструкций от коррозии гальванические аноды, такие как цинковые аноды, изготавливаются из металлов с отрицательным электродным потенциалом. Эти аноды будут предпочтительно окисляться и сохранять свою структуру, защищая тем самым более ценные металлы от коррозии.
Гальванические элементы и их описание
Гальванический элемент - это устройство, позволяющее преобразовывать химическую энергию в электрическую энергию. Он состоит из двух электродов, погруженных в электролит, и обеспечивает разность потенциалов между ними.
Главные элементы гальванической ячейки - электроды. Один из электродов называется анодом, а другой - катодом. В процессе работы элемента происходят окислительно-восстановительные реакции на поверхности электродов, что приводит к образованию потенциала разности электрического заряда.
Значение электродного потенциала каждого из электродов влияет на работу гальванического элемента. Обычно электроды измеряют относительно стандартного водородного электрода, который имеет нулевое значение электродного потенциала.
Некоторые металлы, такие как магний или алюминий, имеют отрицательное значение электродного потенциала. Это связано с их способностью быстро реагировать с окружающей средой и образовывать ионы. В результате таких реакций происходит освобождение электронов, что приводит к отрицательному заряду электрода и его отрицательному электродному потенциалу.
Такие металлы могут использоваться в качестве анода в гальванических элементах. Они служат источником электронов в процессе реакции окисления, в результате чего происходит выделение электрической энергии. Однако, для полноценной работы гальванического элемента, необходимо наличие катода с положительным значением электродного потенциала.
Электроды и их роль в гальванических элементах

Гальванический элемент является устройством, способным преобразовывать химическую энергию в электрическую энергию. Основными компонентами гальванического элемента являются два электрода, а также электролит, обеспечивающий проводимость ионов.
Каждый из электродов имеет свое электродное потенциал, которое определяется его способностью отдавать или принимать электроны. Электроды могут иметь как положительное, так и отрицательное значение электродного потенциала.
Положительное значение электродного потенциала означает, что электрод способен принимать электроны, то есть он является сильным окислителем. Отрицательное значение электродного потенциала, наоборот, указывает на то, что электрод способен отдавать электроны, то есть он является сильным восстановителем.
Значение электродного потенциала влияет на направление потока электронов в гальваническом элементе. Если разность электродных потенциалов положительная, то электроны будут течь от электрода с более отрицательным значением потенциала к электроду с более положительным значением потенциала. Этот поток электронов создает электрический ток, который может быть использован для питания электрических устройств.
Одним из примеров гальванического элемента с отрицательным значением электродного потенциала является элемент на основе цинка и меди. В этом элементе цинковый электрод имеет более отрицательное значение электродного потенциала, поэтому он выступает в качестве восстановителя, отдавая электроны. Медный электрод, в свою очередь, имеет более положительное значение электродного потенциала и принимает электроны, выполняя роль окислителя. Таким образом, между электродами возникает разность потенциалов, которая используется для генерации электрического тока.
Анод и его свойства
Анод - это электрод, на котором происходит окислительная полуреакция в электрохимической системе. В общем случае, анод является металлическим электродом, обладающим отрицательным значением электродного потенциала. Отрицательное значение электродного потенциала объясняется тем, что анод представляет металл, который легко окисляется.
Анод обладает рядом особенных свойств. Во-первых, анод является местом выделения электролизных процессов, то есть на аноде происходит окисление вещества. Также анод обладает свойством притягивать к себе отрицательно заряженные ионы из электролита.
Анод часто используется в различных электрохимических процессах, таких как электролиз, гальваническое покрытие металлом, аккумуляторные батареи и другие. В этих процессах анод играет важную роль, обеспечивая поступление электронов на катод и возможность электролизных процессов.
Важно отметить, что значение электродного потенциала анода может изменяться в зависимости от условий и среды, в которой находится электрод. Однако, независимо от конкретного значения электродного потенциала, анод всегда является местом окисления и осуществления электрохимических процессов.
Катод и его свойства

Катод – это один из двух электродов в электрохимической системе. Он является отрицательным полюсом, на который направлено движение электронов.
У катода есть несколько важных свойств.
- Полярность: Катод всегда имеет отрицательную полярность, что означает, что он принимает электроны.
- Реактивность: Катод может реагировать химически с другими веществами, изменяя свое состояние или состав. Например, при взаимодействии с кислородом, стальной катод может окисляться и образовывать ржавчину.
- Электрохимический потенциал: Катод имеет отрицательное значение электродного потенциала. Это связано с его способностью принимать электроны. Электродный потенциал катода можно использовать для определения относительной реактивности различных веществ и для прогноза направления электрохимических реакций.
- Электролиз: Катод также играет важную роль в электролизе, процессе, при котором электрический ток используется для разделения веществ на составляющие их элементы. На катоде происходит процесс восстановления, при котором ионы с получением электронов превращаются в нейтральные атомы или молекулы.
Изучение свойств катода позволяет понять его роль в электрохимических процессах и использовать его в различных приложениях, включая гальванические элементы, электролиз и электрохимическую коррозию.
Окисление и восстановление металлов
Металлы могут быть окислены или восстановлены в химических реакциях, происходящих в растворах или при контакте с другими веществами. Окисление - это процесс, при котором металл теряет электроны, восстановление - это процесс, в результате которого металл получает электроны.
Отрицательное значение электродного потенциала у некоторых металлов связано с их способностью легко окисляться. Когда металл вступает в реакцию окисления, он отдает свои электроны веществу, с которым взаимодействует. Это вызывает образование положительного иона металла и электрона, который переходит на другую половину реакции.
На основе электродного потенциала металлов можно построить электрохимический ряд, где наибольшее по отрицательности значение имеет самый активный металл. Восстановление металла происходит при контакте с веществом, которое имеет более положительное значение электродного потенциала. Металл принимает электроны от вещества и образует положительный ион.
Причина отрицательного электродного потенциала у некоторых металлов заключается в их электрохимической активности. Чем активнее металл, тем он более склонен к окислению. Водород, лихидий и калий являются самыми активными металлами и имеют самые отрицательные значения электродного потенциала.
Электродный потенциал металлов является важным параметром, который определяет теоретическую возможность реакции окисления или восстановления. Отрицательное значение электродного потенциала у некоторых металлов объясняет их высокую реактивность и способность вступать в химические реакции с другими веществами.
Практическое применение металлов с отрицательным электродным потенциалом

Металлы с отрицательным электродным потенциалом имеют широкое практическое применение в различных областях.
Один из наиболее распространенных способов использования таких металлов - это их применение в гальванических элементах и батареях.
Именно металлы с отрицательным электродным потенциалом служат отрицательными электродами в этих устройствах.
Самым известным примером того, как металл с отрицательным электродным потенциалом используется в гальванических элементах, является цинк.
Он часто используется в алкалиновых батареях, таких как батарейки питания для различных электронных устройств.
Еще одним примером практического применения металлов с отрицательным электродным потенциалом являются аноды в электрохимических процессах.
Например, магний используется в анодных защитных покрытиях для коррозионной защиты сталных конструкций.
Это позволяет избежать процесса коррозии, так как магний как отрицательный электрод обеспечивает анодную защиту.
Отрицательный электродный потенциал металлов также находит применение в различных процессах нанесения покрытий, осаждении металла и электролизе.
Например, металлы с отрицательным электродным потенциалом часто используются в гальваническом методе нанесения покрытий на различные поверхности.
Это позволяет создавать защитные слои, изменять эстетический вид и улучшать технические характеристики изделий.
В целом, металлы с отрицательным электродным потенциалом играют важную роль в различных областях, таких как электрохимия, электроника, металлургия и другие.
Их способность к электронному переносу и взаимодействию с другими материалами делает их неотъемлемой частью многих технологических процессов и применений.
Вопрос-ответ
Зачем некоторым металлам присваивается отрицательное значение электродного потенциала?
Некоторые металлы имеют отрицательное значение электродного потенциала, потому что они обладают большей способностью снижать свою энергию относительно стандартного водородного электрода. Это связано с глубиной расположения электронов в электромагнитной серии напряжения.
Почему некоторые металлы имеют отрицательное электродное потенциал?
Отрицательное значение электродного потенциала у некоторых металлов объясняется тем, что они имеют большую электроотрицательность и способность принимать электроны от других веществ. Такие металлы реагируют более активно с окружающей средой и имеют большую способность к окислению.
Почему у некоторых металлов более низкое значение электродного потенциала?
У некоторых металлов более низкое значение электродного потенциала обусловлено их химической активностью. Эти металлы обладают большей склонностью отдавать электроны в окружающую среду и реагировать с другими веществами. Такие металлы являются сильными восстановителями.
Каким образом некоторые металлы получают отрицательное значение электродного потенциала?
Некоторые металлы получают отрицательное значение электродного потенциала благодаря своей электрохимической активности. Они легко вступают в окислительно-восстановительные реакции, в результате которых принимают электроны от окружающих веществ, что приводит к появлению отрицательного потенциала. Такие металлы являются хорошими восстановителями.
