Оксиды металлов являются химическими соединениями, состоящими из металлического и кислородного атомов, связанных ковалентной или ионной связью. Многие оксиды металлов могут подвергаться восстановлению, то есть принимать один или несколько электронов от другого вещества. Водород является одним из веществ, способных восстановить оксиды металлов и образовать соединения с меньшей степенью окисления.
Одним из примеров такого восстановления является реакция оксида меди(II) с водородом. При нагревании оксид меди(II) в присутствии водорода, происходит реакция, в результате которой образуется металлическая медь и вода. Такая реакция получила название восстановления оксида. Аналогичные реакции могут происходить и с другими оксидами металлов, такими как оксид железа, оксид марганца или оксид никеля.
Восстановление оксидов металлов водородом широко используется в промышленности. Например, возможность восстановления оксидов металлов позволяет получать металлы из их руд. Также восстановление оксидов металлов является важным этапом в производстве различных химических соединений, таких как соли и органические соединения. Вместе с тем, восстановление оксидов металлов водородом имеет применение и в различных областях науки и техники, в частности в электрохимии, энергетике и катализе.
Оксиды металлов
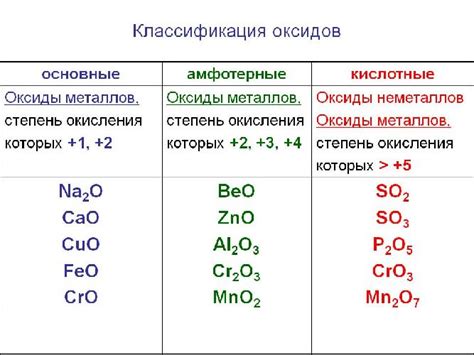
Оксиды металлов являются химическими соединениями, состоящими из металла и кислорода. Эти соединения имеют широкое применение в различных отраслях, включая промышленность, электронику, фармацевтику и другие. Большинство металлов могут образовывать оксиды, и в зависимости от химического состава и свойств, они могут иметь различные цвета, структуру и свойства.
Оксиды металлов могут быть изменены с помощью веществ, содержащих водород. В химической реакции, известной как восстановление, водород проникает в структуру оксида металла и замещает кислород. В результате происходит образование воды и металла. Восстановление оксидов металлов водородом может проводиться на промышленных предприятиях, а также в лаборатории при научных исследованиях.
Оксиды металлов, которые могут быть восстановлены водородом, включают:
- Оксид железа (III) (Fe2O3), который при взаимодействии с водородом образует железо и воду;
- Оксид меди (CuO), который при восстановлении водородом образует медь и воду;
- Оксид свинца (PbO), который при реакции с водородом превращается в свинец и воду;
- Оксид цинка (ZnO), который путем восстановления водородом превращается в цинк и воду.
Восстановление оксидов металлов водородом имеет важное практическое значение. Оно позволяет получать металлы из их оксидов, что является одним из методов добычи и обработки различных металлургических сырьевых материалов. Также это процесс может использоваться для очистки и легирования металлов, а также для выделения определенных химических соединений.
Механизм восстановления оксидов
Восстановление оксидов металлов водородом является важной реакцией, особенно в области катализа. Механизм этого процесса включает несколько основных этапов.
На первом этапе происходит адсорбция молекулы водорода на поверхности оксида металла. Эта адсорбция может происходить физически или химически, в зависимости от природы металла и оксида. Адсорбция водорода увеличивает положительный заряд на поверхности оксида и становится инициатором последующих реакций.
На втором этапе происходит диссоциация водорода на поверхности оксида. Это происходит под воздействием высокой температуры и энергии адсорбции. Диссоциация ведет к освобождению атомов водорода, которые становятся активными и способными взаимодействовать с оксидом металла.
На третьем этапе происходит реакция между активными атомами водорода и оксидом металла. Эта реакция может протекать различными путями в зависимости от температуры, давления и концентрации водорода. В результате металл восстанавливается из оксида, а вода образует продукт.
Механизм восстановления оксидов водородом может быть разным в зависимости от конкретной системы и условий проведения реакции. Изучение этого механизма является актуальной задачей, так как позволяет разрабатывать эффективные катализаторы и процессы восстановления металлов.
Оксиды металлов, подходящие для восстановления водородом
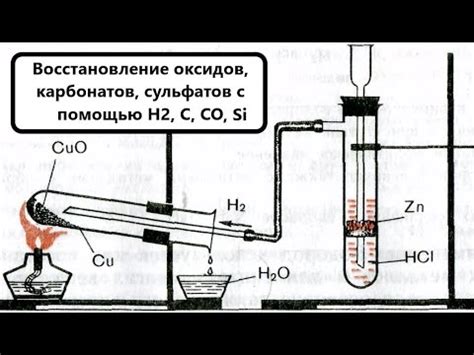
Восстановление металлических оксидов водородом является важным процессом в химической промышленности. Оксиды металлов, которые могут быть восстановлены водородом, обладают определенным набором свойств и имеют широкий спектр применения.
Оксид меди (II) (CuO) - это один из наиболее распространенных оксидов металлов, подходящих для восстановления водородом. Он обычно используется в производстве медных сплавов, керамики, а также в катализаторах.
Оксид железа (III) (Fe2O3) - это важный оксид металла, который может быть восстановлен водородом. Он широко используется в производстве стали, магнитных материалов, а также в качестве пигмента в красках и пластике.
Оксид цинка (ZnO) - еще один оксид, который может быть восстановлен водородом. Он используется в производстве резиновых изделий, светофильтров, а также в косметической промышленности.
Оксид алюминия (Al2O3) - это один из самых важных оксидов металлов, который может быть восстановлен водородом. Он используется в производстве алюминия, керамики, стекла, а также в каталитических процессах.
Оксид никеля (NiO) - это также важный оксид металла, который может быть восстановлен водородом. Он используется в производстве никелевых сплавов, а также в каталитических процессах.
Это лишь некоторые из оксидов металлов, которые могут быть восстановлены водородом. Их использование широко распространено в различных отраслях промышленности, и этот процесс является важным элементом многих технологических процессов.
Влияние восстановления на свойства оксидов
Восстановление оксидов металлов водородом может иметь значительное влияние на их свойства. При восстановлении оксиды претерпевают изменения в своей структуре и составе, что может привести к появлению новых физических и химических свойств. Это делает эти вещества интересными для различных промышленных и научных приложений.
Одно из самых заметных изменений, которое происходит при восстановлении оксидов металлов, связано с изменением расположения ионов в решетке кристаллической структуры. В результате этого изменения могут происходить изменения в электрохимической активности материала, что влияет на его способность к реакциям с другими веществами.
Восстановление оксидов металлов водородом также может приводить к изменению электропроводности этих материалов. Увеличение электропроводности может быть полезным свойством для применения оксидов в различных электронных устройствах и сенсорах.
Кроме того, процесс восстановления оксидов металлов может привести к изменению их оптических свойств. В результате восстановления оксиды металлов могут стать более прозрачными или изменить цвет. Это может быть полезным для применения оксидов в оптических устройствах или различных типах покрытий.
В целом, восстановление оксидов металлов водородом является важным процессом, который может менять свойства этих веществ. Это открывает новые перспективы для их применения в различных областях науки и промышленности.
Применение восстановленных оксидов металлов

Восстановленные оксиды металлов, полученные с помощью водорода, находят широкое применение в различных сферах промышленности и научных исследованиях.
Одним из основных применений является использование восстановленных оксидов металлов в катализаторах. В катализаторах на основе восстановленных оксидов металлов, таких как никель, железо или платина, происходят химические реакции, которые обычно требуют высокой температуры и давления. Такие катализаторы применяются, например, в процессе производства аммиака или в промышленности полимеров.
Восстановленные оксиды металлов также используются в электронике. Они могут быть применены в качестве материалов для создания электродов или полупроводников. Например, восстановленный оксид железа может использоваться в аккумуляторах или в солнечных батареях.
Кроме того, восстановленные оксиды металлов могут использоваться в процессе сепарации газов. Например, оксид никеля может быть использован для извлечения водорода из смеси газов. Такие процессы очень важны в производстве водородных топливных элементов и водородных батарей.
Научные исследования также активно используют восстановленные оксиды металлов. Они являются идеальным материалом для изучения различных химических и физических процессов. Благодаря своим уникальным свойствам, восстановленные оксиды металлов могут быть использованы в разработке новых материалов и технологий.
Оксиды, которые нельзя восстановить водородом
Оксиды металлов весьма разнообразны и только некоторые из них могут быть восстановлены водородом. Однако есть группа оксидов, которые нельзя восстановить с помощью водорода.
Первым из таких оксидов является оксид алюминия (Al2O3). Он обладает высокой степенью устойчивости к восстановлению водородом. Это связано с сильным химическим связыванием атомов кислорода и алюминия, которое нельзя разорвать силами водорода.
Вторым примером является оксид кремния (SiO2). Этот оксид также является очень устойчивым и не может быть восстановлен водородом. Кремний окисляется только очень активными веществами, такими как фтор, хлор и бром.
Оксид железа (Fe2O3) также относится к оксидам, которые нельзя восстановить водородом. Железо в оксиде находится в высокой степени окисления, что делает его непригодным для восстановления водородом.
Таким образом, не все оксиды металлов поддаются восстановлению с помощью водорода. Оксиды алюминия, кремния и железа являются примерами оксидов, которые нельзя восстановить водородом.
Альтернативные методы восстановления
Помимо восстановления оксидов металлов водородом, существуют и другие методы, которые могут быть использованы для восстановления этих соединений. Они основаны на различных химических реакциях и позволяют получить восстановленные металлы без использования водорода.
Один из альтернативных методов восстановления – это использование соединений алюминия. Алюминий является сильным окислителем и может восстанавливать оксиды металлов. Для этого требуется провести реакцию между алюминием и оксидом металла при высокой температуре. В результате такой реакции алюминий окисляется, а оксид металла восстанавливается к соответствующему металлу. Полученные металлы имеют высокую степень очистки и часто используются в различных отраслях промышленности.
Другой метод восстановления оксидов металлов – это использование химических веществ, которые сами являются сильными восстановителями. Например, некоторые органические соединения, такие как спирты или аминовые соединения, могут быть использованы для восстановления оксидов металлов. Для этого проводят реакцию между восстановителем и оксидом металла в присутствии катализатора. В результате такой реакции оксид металла восстанавливается к металлу, а восстановитель окисляется.
Кроме того, существуют методы восстановления оксидов металлов с помощью электрохимических процессов. Один из таких методов – электролиз. При этом методе оксид металла растворяют в специальной электролите и пропускают через него электрический ток. Под действием тока оксид металла восстанавливается к металлу на электроде. Электролиз широко применяется в производстве металлов с использованием возобновляемых источников энергии, таких как солнечная или ветровая энергия.
Все эти методы восстановления оксидов металлов имеют свои преимущества и недостатки. Выбор метода зависит от требуемых условий процесса и свойств оксидов металлов. Однако основная цель всех этих методов – получить восстановленные металлы с высокой степенью очистки и минимальными затратами энергии и ресурсов.
Основные аспекты химической реакции
Химическая реакция представляет собой процесс, при котором происходят изменения в химическом составе вещества. Она характеризуется взаимодействием реагентов и образованием новых веществ – продуктов реакции. В данном случае рассматривается химическая реакция восстановления оксидов металлов водородом.
Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Эти соединения обладают свойством легко взаимодействовать с водородом и могут быть восстановлены при его участии. В химической реакции образуется вода и металлический металл, а оксиды металлов теряют свои свойства окислителя.
Восстановление оксидов металлов водородом происходит при определенных условиях: наличии водорода в достаточном количестве, повышенной температуре и в присутствии катализаторов. Водород выступает в данной реакции в качестве восстанавливающего агента, способного перевести металл в более низкую степень окисления.
Химическая реакция восстановления оксидов металлов водородом имеет разнообразные применения в промышленности, например, в получении металлических порошков или восстановлении металлов из их соединений. Эта реакция также может использоваться для очистки газов от оксида серы или других примесей, а также для производства водорода.
Вопрос-ответ
Какие металлы могут быть восстановлены водородом?
Водород способен восстанавливать большинство металлов, включая цинк, алюминий, медь, железо и титан.
Для чего используется восстановление металлов водородом?
Восстановление металлов водородом может использоваться в различных процессах, таких как производство металлических порошков, очистка металлов от примесей и армирование металлических изделий.
Как происходит процесс восстановления металлов водородом?
Восстановление металлов водородом происходит путём образования металлического гидрида. Водород проникает в структуру металла, меняя его свойства и превращая его в гидрид.
Какие оксиды металлов могут быть восстановлены водородом?
Оксиды металлов, которые могут быть восстановлены водородом, включают оксиды цинка, алюминия, железа, меди и титана.

