В химии щелочноземельных металлов, таких как бериллий, магний, кальций, стронций, барий и радий, высший оксид представлен общей формулой MO2. Это соединение является одним из наиболее стабильных оксидов щелочноземельных металлов и обладает рядом уникальных свойств.
Формула MO2 указывает на то, что каждый щелочноземельный металл соединяется с двумя атомами кислорода. Такая структура имеет симметричное расположение атомов и образует ионную сетку. Это делает высший оксид щелочноземельных металлов стабильным и твердым соединением с высокой температурой плавления.
Высший оксид щелочноземельных металлов обладает выраженными редокс-свойствами и может служить и как окислитель, и как восстановитель. Материалы на основе высшего оксида могут использоваться в различных областях, таких как электрохимия, катализ и электроника.
Изучение общей формулы высшего оксида щелочноземельных металлов позволяет лучше понять структуру и свойства этих соединений, а также их потенциальное применение в различных областях науки и технологии.
Определение высшего оксида щелочноземельных металлов

Высший оксид щелочноземельных металлов представляет собой соединение, состоящее из кислорода и металла данной группы, химической формулой XO, где X обозначает металл. Оксиды щелочноземельных металлов являются основными оксидами, так как при реакции с водой образуют щелочи.
Высшие оксиды щелочноземельных металлов имеют структуру ионной решетки и обладают высокой теплостойкостью. Они образуют кристаллы соединений, в которых положительные ионы металла окружены отрицательными ионами кислорода. Такие соединения обладают характерными свойствами щелочных соединений: щелочными растворимыми солями, способностью образовывать щелочные гидроксиды при реакции с водой.
Высшие оксиды щелочноземельных металлов играют важную роль в различных отраслях науки и промышленности. Кальциевый оксид (известь) используется в строительстве и производстве цемента, магниевый оксид применяется в стекольной и керамической промышленности, барий оксид используется при производстве стекол и электронных компонентов.
Высшие оксиды щелочноземельных металлов также используются в химических реакциях в качестве катализаторов и ингибиторов. Они могут быть использованы для регулирования скорости химических процессов и управления их направлением. Кроме того, некоторые высшие оксиды щелочноземельных металлов имеют свойства фотокаталитического окисления, что позволяет использовать их в солнечных батареях и экологически чистых процессах.
Состав и химический символ
Высший оксид щелочноземельных металлов - это соединение, которое состоит из атомов металла и кислорода. Химический символ высшего оксида представляет собой комбинацию символов металла и кислорода в определенной пропорции. Все щелочноземельные металлы имеют свои высшие оксиды, каждый из которых имеет уникальный химический символ.
Высший оксид кальция, например, обозначается символом CaO, где Ca - символ кальция, а O - символ кислорода. Риндеоказатель высшего оксида магния записывается как MgO, где Mg - символ магния, а O - символ кислорода.
Состав и химический символ высшего оксида щелочноземельного металла зависят от электрохимического поведения металла и его соотношения с кислородом. Количество атомов металла и кислорода в высшем оксиде может быть различным в зависимости от соотношения.
Например, в высшем оксиде бария (BaO) один атом бария соединяется с одним атомом кислорода, в то время как в высшем оксиде магния (MgO) один атом магния соединяется с двумя атомами кислорода.
Таким образом, высший оксид щелочноземельного металла имеет определенный состав и химический символ, который отражает соотношение атомов металла и кислорода в соединении.
Главные свойства высшего оксида

1. Структура и формула. Высший оксид щелочноземельных металлов (обычно называемый пероксидом) имеет общую формулу MO2, где M - щелочноземельный металл. Структура высшего оксида представляет собой кристаллическую решётку, в которой ионы металла окружены ионами кислорода.
2. Физические свойства. Высший оксид щелочноземельных металлов является белым кристаллическим веществом с высокой температурой плавления. Он обладает хорошей растворимостью в воде и образует перекисные соединения. Высшие оксиды обладают сильным окислительным действием.
3. Химические свойства. Высшие оксиды щелочноземельных металлов обладают основными свойствами и образуют едкие щелочные гидроксиды при реакции с водой. Они также могут реагировать с кислотами, образуя соли и воду. Высший оксид магния (MgO) обладает способностью поглощать углекислый газ из воздуха.
4. Применение. Высшие оксиды щелочноземельных металлов находят широкое применение в разных отраслях. Например, оксид кальция (CaO) используется в строительстве для производства гипсокартонных плит и цемента. Оксид магния (MgO) применяется в медицине для производства антацидных препаратов и в производстве огнеупорных материалов.
В целом, высший оксид щелочноземельного металла - важное соединение с разнообразными свойствами и широким кругом применений.
Применение высшего оксида
Высший оксид щелочноземельного металла - это химическое соединение, которое имеет широкий спектр применений в различных отраслях промышленности и научных исследованиях.
Строительство: Высший оксид часто используется в строительстве в качестве сырья для производства различных строительных материалов, таких как цемент, штукатурка и бетон. Это обусловлено его способностью образовывать стойкие и прочные связи между частицами материала.
Металлургия: Высший оксид щелочноземельного металла может использоваться в металлургических процессах для удаления примесей из расплавленного металла. Он действует как окислитель, удаляя нечистоты и улучшая качество окончательного продукта.
Электроника: В электронике высший оксид используется в производстве полупроводниковых материалов и электротехнических устройств. Он обладает высокой диэлектрической проницаемостью, что позволяет использовать его в изготовлении конденсаторов, транзисторов и других компонентов.
Катализатор: Высший оксид щелочноземельного металла может служить катализатором в различных химических реакциях. Он способен ускорять скорость реакции и повышать ее эффективность, что находит применение в производстве различных химических веществ и материалов.
Лабораторные исследования: Высший оксид щелочноземельного металла широко применяется в научных исследованиях и лабораторных работах. Он может использоваться в качестве реагента для проведения химических экспериментов, а также как стандартный образец для анализа и калибровки различных методик и приборов.
Примеры высших оксидов щелочноземельных металлов
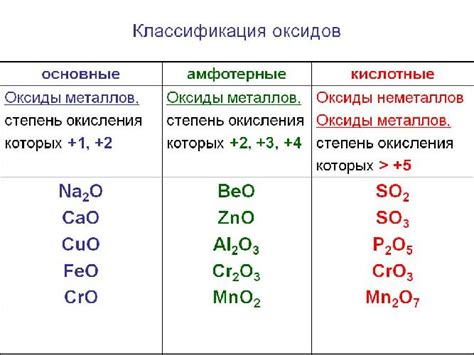
Щелочноземельные металлы представлены элементами из второй группы периодической таблицы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они образуют соединения с кислородом, называемые высшими оксидами. Эти соединения имеют общую формулу MО, где М обозначает щелочноземельный металл.
Примером высших оксидов щелочноземельных металлов является оксид бериллия (BeO). Он образуется путем соединения бериллия с кислородом. Оксид бериллия имеет кристаллическую структуру и обладает высокой термической и химической стабильностью. Он используется в производстве керамики, электронных компонентов и защитных покрытий.
Еще одним примером высшего оксида щелочноземельного металла является оксид магния (MgO). Он получается путем соединения магния с кислородом. Оксид магния имеет белый цвет и обладает высокой твердостью. Он используется во многих отраслях промышленности, включая производство цемента, огнеупорных материалов и лекарственных препаратов.
В ряду высших оксидов щелочноземельных металлов можно отметить также оксид кальция (CaO), оксид стронция (SrO), оксид бария (BaO) и оксид радия (RaO). Каждый из них обладает своими уникальными свойствами и применяется в различных сферах науки и промышленности.
Вопрос-ответ
Какова общая формула высшего оксида щелочноземельных металлов?
Общая формула высшего оксида щелочноземельных металлов может быть представлена как MO2, где M обозначает щелочноземельный металл.
Какие металлы относятся к щелочноземельным?
К щелочноземельным металлам относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
В чем состоит особенность высших оксидов щелочноземельных металлов?
Особенностью высших оксидов щелочноземельных металлов является то, что они имеют общую формулу MO2 и образуют соединения с кислородом, которые обладают свойствами окислителей и образуют сильные основания.
Какова структура высших оксидов щелочноземельных металлов?
Структура высших оксидов щелочноземельных металлов обычно является ионно-кристаллической, где каждый ион металла окружен шестью ионами кислорода. Такая структура обусловливает высокую твердость и температуру плавления этих соединений.
Какова роль высших оксидов щелочноземельных металлов в промышленности?
Высшие оксиды щелочноземельных металлов находят широкое применение в различных отраслях промышленности. Например, оксиды кальция (CaO) и магния (MgO) используются для производства цемента и стекла, а оксид бериллия (BeO) применяется в электронике и ядерной технике.