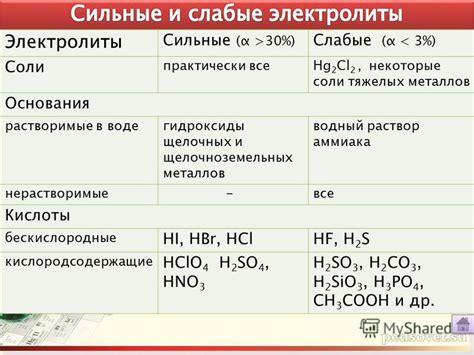
Нерастворимые соли щелочных металлов являются классом соединений, которые обладают специфическими свойствами и находят широкое применение в различных областях науки и техники. Щелочные металлы представляют собой элементы периодической системы, входящие в первую группу: литий, натрий, калий, рубидий и цезий.
Свойства нерастворимых солей щелочных металлов тесно связаны с их структурой и химическими связями. Эти соли обладают высокой температурой плавления и кипения, а также низкой растворимостью в воде. Они образуют кристаллические структуры, обладающие высокой устойчивостью и жесткостью.
Применение нерастворимых солей щелочных металлов широко охватывает различные отрасли наук и промышленности. Они используются в производстве стекла, керамики и электроники, а также в фармацевтической и пищевой промышленности. Благодаря своим уникальным химическим и физическим свойствам, нерастворимые соли щелочных металлов находят применение в изготовлении химических реактивов, катализаторов и материалов с высокой стойкостью к коррозии.
Нерастворимые соли щелочных металлов
Нерастворимые соли щелочных металлов - это соединения, обладающие низкой растворимостью в воде. Щелочные металлы включают в себя литий, натрий, калий, рубидий, цезий и франций. Соли этих металлов характеризуются своими уникальными свойствами и находят широкое применение в различных областях.
Нерастворимые соли щелочных металлов используются в качестве катализаторов, пигментов для красок, стекловидных материалов и керамических изделий. Они способны придавать материалам различные оттенки и улучшать их механические и химические свойства.
Одним из наиболее известных примеров нерастворимых солей щелочных металлов являются сульфаты. Калиевый сульфат (K2SO4) и натриевый сульфат (Na2SO4) имеют широкое применение в производстве удобрений, стекла и мыла.
Кроме сульфатов, нерастворимыми солями щелочных металлов являются хлориды, бромиды, йодиды и карбонаты. Например, литиевый карбонат (Li2CO3) используется в фармацевтической и стекольной промышленности, а калиевый хлорид (KCl) применяется в качестве удобрения, а также в производстве солевых растворов и пищевых добавок.
Определение и химический состав
Нерастворимые соли щелочных металлов представляют собой соединения, которые практически не растворяются в воде или растворах кислот. Они образуются при реакции между щелочными металлами (например, натрием, калием, литием) и кислотами сильно основного характера.
Химический состав нерастворимых солей щелочных металлов включает металл и анион (отрицательный ион). Металлом в таких соединениях является один из щелочных металлов, а анионы могут быть различными. Например, для нерасстворимых солей натрия могут использоваться такие анионы, как хлорид, сульфат, карбонат и т.д. Поэтому особенности свойств и применения нерастворимых солей могут быть обусловлены именно выбранным анионом.
Таким образом, определение нерастворимых солей щелочных металлов заключается в том, что они являются соединениями, плохо растворимыми в воде или растворах кислот, и имеют состав, состоящий из щелочного металла и выбранного аниона.
Физические свойства

Нерастворимые соли щелочных металлов обладают определенными физическими свойствами, которые определяют их поведение в различных условиях.
Температура плавления: Нерастворимые соли щелочных металлов обычно обладают высокой температурой плавления. Например, наиболее известная нерастворимая соль - хлорид натрия (NaCl) - плавится при температуре около 801 градуса Цельсия.
Твердость: Нерастворимые соли щелочных металлов обычно являются твердыми веществами. Они могут образовывать кристаллические структуры различных форм, таких как кубики, призмы или пластинки.
Цвет: Некоторые нерастворимые соли щелочных металлов имеют характерные цвета. Например, хлорид калия (KCl) может иметь белый цвет, хлорид лития (LiCl) - бесцветный, а хлорид цезия (CsCl) - желтый.
Магнитные свойства: Большинство нерастворимых солей щелочных металлов не обладает магнитными свойствами. Однако некоторые из них, такие как ферроцианиды и феррицианиды, могут обладать слабым магнетизмом.
Летучесть: Нерастворимые соли щелочных металлов обычно являются нелетучими. Они не испаряются в обычных условиях и остаются твердыми веществами.
Изучение физических свойств нерастворимых солей щелочных металлов позволяет понять их структуру и влияние на различные процессы и реакции, в которых они участвуют. Эти свойства также определяют возможные применения данных соединений в различных областях науки и технологий.
Химические свойства
Нерастворимые соли щелочных металлов обладают рядом характерных химических свойств. Одним из них является их нерастворимость в воде. Нерастворимые соли щелочных металлов образуют осадок или выпадают в виде кристаллов, когда растворы, содержащие эти соли, охлаждаются или высыхают. Благодаря этой особенности такие соли широко используются для очистки и консервации воды.
Кроме того, нерастворимые соли щелочных металлов обладают щелочными свойствами. Это означает, что они способны образовывать щелочные растворы, которые реагируют с кислотами, нейтрализуя их. Такие свойства применяются в промышленности и в лабораторной практике для нейтрализации кислотных веществ и регулирования pH-уровня растворов.
Некоторые нерастворимые соли щелочных металлов обладают также кислотными свойствами, то есть способностью реагировать с основаниями. Это позволяет им использоваться в различных реакциях для синтеза новых соединений и в качестве катализаторов.
Особое внимание следует обратить на электрохимические свойства нерастворимых солей щелочных металлов. Они являются прекурсорами для получения электролитов и используются в процессе производства батарей и аккумуляторов, а также в электросинтезе различных веществ.
Применение в промышленности

Нерастворимые соли щелочных металлов находят широкое применение в различных отраслях промышленности благодаря своим уникальным свойствам. Один из основных способов использования таких солей – это процессы термодинамической обработки материалов.
В металлургической промышленности нерастворимые соли щелочных металлов используются в качестве флюсов, которые помогают улучшить качество и свойства расплавленных металлических материалов. С их помощью происходит удаление примесей, окисленных частиц и нежелательных соединений.
Также эти соли применяются в области стекольного производства, где они играют роль структурирующих и модифицирующих элементов в стеклянных изделиях. Они способствуют улучшению оптических свойств стекла, повышению прочности и стойкости к коррозии.
В электрохимической промышленности нерастворимые соли щелочных металлов используются в процессе электролиза и электрохимического синтеза. Они являются отличными электролитами, способными обеспечить эффективную проводимость электрического тока. Это позволяет получать различные металлы и соединения с высокой степенью чистоты и качества.
В других отраслях промышленности нерастворимые соли используются как катализаторы, стабилизаторы, пигменты, а также для создания различных оттенков и эффектов в косметической и текстильной промышленности.
Применение в научных исследованиях
Нерастворимые соли щелочных металлов, такие как хлорид натрия, хлорид калия и хлорид лития, находят применение в различных научных исследованиях.
В области каталитической химии нерастворимые соли щелочных металлов используются для синтеза и стабилизации катализаторов. Они играют важную роль в процессах гетерогенного катализа, помогая улучшить эффективность и селективность реакции.
В физической и химической биологии нерастворимые соли щелочных металлов используются для создания буферных растворов и поддержания постоянного pH-уровня. Они также могут играть роль в стабилизации белков и других молекул при проведении различных биохимических экспериментов.
Некоторые исследования также связаны с использованием нерастворимых солей щелочных металлов в процессах выделения и анализа различных веществ. Они могут служить источником металлических ионов, которые в дальнейшем могут быть обнаружены и проанализированы различными методами.
В целом, применение нерастворимых солей щелочных металлов в научных исследованиях связано с их уникальными свойствами и способностью взаимодействовать с другими веществами, что позволяет решать различные научные задачи и проводить более точные исследования.
Взаимодействие с другими веществами
Нерастворимые соли щелочных металлов проявляют различное взаимодействие с другими веществами в зависимости от своих химических свойств. Например, многие из них обладают высокой теплоустойчивостью и могут использоваться в процессах термообработки металлов.
Одним из наиболее распространенных взаимодействий является ионный обмен, при котором ионы нерастворимой соли могут обмениваться с ионами другого вещества. Этот процесс может приводить к образованию новых соединений и изменению физических и химических свойств обоих веществ.
Некоторые нерастворимые соли щелочных металлов могут также реагировать с кислотами, образуя растворимые соли и выделяяся газы. Например, гидроксид натрия реагирует с соляной кислотой, образуя хлорид натрия и выделяя газ воду.
Кроме того, некоторые нерастворимые соли щелочных металлов могут взаимодействовать с органическими веществами, такими как спирты, приводя к образованию новых органических соединений.
Влияние на окружающую среду
Использование нерастворимых солей щелочных металлов может оказывать негативное влияние на окружающую среду. Одной из проблем, связанных с использованием этих веществ, является их низкая степень растворимости. В результате, соли оседают на поверхностях почвы и водных образований, что может приводить к загрязнению природных резервуаров.
Нерастворимые соли щелочных металлов могут оказывать токсическое действие на растения, животных и микроорганизмы. При попадании в почву или воду эти соли способны изменять pH-среду и нарушать баланс микроэлементов, что приводит к ухудшению условий обитания для различных организмов.
Кроме того, отложение нерастворимых солей щелочных металлов на поверхностях инфраструктуры, таких как здания и транспортные средства, может приводить к их коррозии и повреждению. Это может потребовать значительных затрат на ремонт и замену поврежденных объектов.
<
Вопрос-ответ
Какие соли щелочных металлов считаются нерастворимыми?
Нерастворимыми считаются соли щелочных металлов, такие как гидроксиды, сульфиды, карбонаты, фосфаты и многие другие.
Какие свойства характерны для нерастворимых солей щелочных металлов?
Нерастворимые соли щелочных металлов обычно имеют низкую растворимость в воде, а также обладают высокой температурой плавления и кипения.
Какие применения имеют нерастворимые соли щелочных металлов?
Нерастворимые соли щелочных металлов имеют широкое применение в различных отраслях. Например, они используются в производстве стекла, керамики, мыла, детергентов, а также в медицине, сельском хозяйстве и других областях.
Как нерастворимые соли щелочных металлов влияют на окружающую среду?
Некоторые нерастворимые соли щелочных металлов могут быть токсичными и оказывать негативное воздействие на окружающую среду. Например, сульфиды щелочных металлов могут вызывать загрязнение грунтовых и поверхностных вод, а некоторые другие соли могут быть опасными при попадании в организм животных и человека.
Какие методы используются для получения нерастворимых солей щелочных металлов?
Нерастворимые соли щелочных металлов могут быть получены путем реакции щелочных металлов с соответствующими кислотами или солями. Также, некоторые из этих солей могут быть получены путем осаждения из растворов и эвтектического смешения.
Какие свойства нерастворимых солей щелочных металлов позволяют использовать их в производстве стекла и керамики?
Нерастворимые соли щелочных металлов обладают высокой температурой плавления, что позволяет использовать их в производстве стекла и керамики. Они также могут играть роль стекловидных флюсов, которые способствуют понижению температуры плавления других компонентов стекла или керамики.
