Na2O – это бинарный неорганический соединение, которое представляет собой оксид определенного элемента. Данное соединение образуется при реакции натрия (Na) с кислородом (O).
Наименование соединения "Na2O" можно расшифровать следующим образом: "Na" обозначает символ натрия в периодической системе элементов, а "O" – символ кислорода. Таким образом, мы можем сделать вывод, что Na2O – это оксид натрия.
Оксид натрия используется в различных сферах. Например, он широко применяется в стекольной промышленности для придания желаемых свойств стеклу. Также на основе Na2O производят технические и пищевые щелочи. Благодаря своим свойствам, оксид натрия является важным компонентом в процессе выплавки металлов и получения керамики.
Na2O: оксид натрия
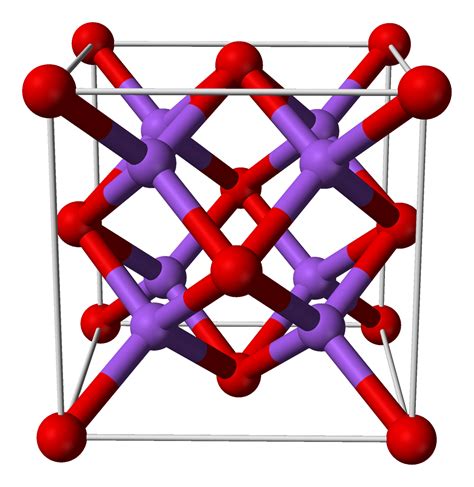
Na2O – это химическое соединение, известное как оксид натрия. Он образуется при реакции натрия с кислородом. Формула Na2O указывает на наличие двух атомов натрия и одного атома кислорода.
Оксид натрия Na2O представляет собой белый кристаллический порошок. Он является основным оксидом натрия и обладает высокой щелочностью. Оксид натрия растворяется в воде, образуя щелочную среду.
Na2O широко используется в различных сферах. Например, его применяют в процессе производства стекла, так как оно придает стеклу основные свойства и позволяет ему быть прозрачным и прочным. Оксид натрия также используется в производстве мыла, бытовых и промышленных моющих средств, а также в качестве обезжиривающего агента.
В лаборатории оксид натрия Na2O может быть использован в качестве реагента для различных химических экспериментов и синтеза соединений. По своим свойствам оксид натрия имеет большое значение в химической промышленности и в научных исследованиях.
Таким образом, Na2O или оксид натрия – это химическое соединение, широко применяемое в различных областях, таких как стекольная промышленность, производство бытовой химии и химические эксперименты.
Свойства
Оксид натрия (Na2O) обладает рядом свойств, которые определяют его химическое и физическое поведение.
1. Степень окисления: Натрий в оксиде находится в степени окисления +1, а кислород -2.
2. Растворимость: Na2O растворяется в воде, образуя щелочную среду. При этом происходит гидратация оксида, то есть соединение с водой.
3. Кислотность: Na2O обладает щелочными свойствами и реагирует с кислотами, образуя соли и воду.
4. Кристаллическая структура: Na2O образует кристаллы, в которых натрий и кислород образуют кубическую решетку.
5. Температура плавления: Температура плавления Na2O достигает 1132 °C.
6. Электрические свойства: В твердом состоянии оксид натрия не проводит электрический ток, однако при плавлении или растворении в воде становится проводником.
7. Применение: Оксид натрия широко применяется в стекольной промышленности для получения жидкого стекла, а также в производстве щелочей, моющих средств, электролитов и других химических соединений.
В целом, оксид натрия обладает интересными свойствами и находит широкое применение в различных отраслях промышленности и химии.
Способы получения Na2O

Na2O является химическим соединением, состоящим из натрия и кислорода. Оно получается различными способами, в зависимости от целей и условий процесса.
Одним из способов получения Na2O является реакция сгорания натрия в кислороде. Для этого натрий помещают в специальную ампулу с кислородом и поджигают его. В результате сгорания образуется оксид натрия.
Другим способом является термическое разложение натриевого нитрата. При нагревании натриевого нитрата он распадается на оксид натрия и кислород. Оксид натрия можно извлечь из полученной смеси.
Также Na2O можно получить путем обработки натрия паром воды. В результате реакции натрий реагирует с водой, образуя оксид натрия и выделяя водород. После этого оксид натрия можно извлечь и использовать в различных промышленных процессах.
Следует отметить, что способ получения Na2O может зависеть от его использования и требований к чистоте получаемого продукта. Поэтому в каждом конкретном случае выбирается оптимальный способ получения.
Применение
Na2O, или натриевый оксид, является важным химическим соединением с множеством применений в различных отраслях промышленности и научных исследований.
Одним из основных применений Na2O является его использование в производстве стекла. Благодаря своей высокой расплавляемости и способности образовывать стекловидную структуру, натриевый оксид используется в качестве стеклонаполнителя и стеклосвязующего в различных типах стекла, включая оконное стекло, посуду, зеркала и фотоэлектрические панели.
Na2O также широко применяется в производстве щелочи и щелочных солей. Благодаря своим щелочным свойствам, натриевый оксид используется для производства гидроксида натрия (NaOH) и различных солей, таких как нитраты, сульфаты и карбонаты. Эти соединения находят применение в производстве мыла, стекловолокна, удобрений и многих других химических продуктов.
Кроме того, Na2O используется в процессе обезвоживания или сушки растворов. Натриевый оксид обладает сильными сушильными свойствами и может эффективно удалять воду из растворов, увеличивая их концентрацию и стабилизируя химические реакции.
В научных исследованиях Na2O используется для изучения дефектов кристаллической структуры и механизмов реакций. Натриевый оксид также является предшественником для получения других соединений в химических синтезах, что позволяет исследователям изучать и разрабатывать новые материалы и технологии.
Влияние на окружающую среду

Na2O, или натриевый оксид, является химическим соединением, которое может оказывать негативное влияние на окружающую среду. Этот оксид способен взаимодействовать с влагой в воздухе, образуя натриевую гидроксидную соль (NaOH) – щелочное растворимое вещество с высокой щелочностью.
Попадая в природные водоемы, натриевый оксид может вызывать значительное изменение показателей pH, что приводит к изменениям в экосистеме. Это может негативно повлиять на водные организмы, вызывая их гибель или нарушение активности.
Кроме того, натриевый оксид может вызывать серьезные ожоги кожи и раздражение слизистых оболочек. Это связано с его высокой щелочностью и агрессивными свойствами. Следовательно, натриевый оксид является опасным веществом из-за своего потенциала вызывать травмы и воздействовать на здоровье людей и животных.
Для смягчения влияния на окружающую среду рекомендуется правильное хранение, транспортировка и утилизация натриевого оксида. Он должен храниться в специальных контейнерах, отдельно от других химических веществ, и избегать протекания или выпадания на почву и в водные источники.
Таким образом, натриевый оксид – это химическое соединение, которое имеет потенциал негативного воздействия на окружающую среду. Правильное хранение и обращение с этим веществом являются важными мерами для минимизации его возможных негативных последствий для окружающей среды и здоровья людей и животных.
Опасность и меры предосторожности
Na2O - это щелочной оксид, который обладает определенной опасностью для здоровья человека. Действие оксида натрия может быть раздражающим и высушивающим для кожи и слизистых оболочек. Поэтому важно принимать некоторые меры предосторожности при работе с этим веществом.
1. Используйте защитные средства: при работе с Na2O необходимо надевать перчатки, защитные очки и средства для защиты дыхания. Такая мера предосторожности поможет предотвратить непосредственный контакт с веществом и минимизировать его негативное воздействие на организм.
2. Обеспечьте хорошую вентиляцию помещения: оксид натрия можно вдыхать, поэтому при работе с ним необходимо обеспечить хорошую вентиляцию помещения. Это поможет снизить концентрацию вредных паров и пыли в воздухе и уменьшить риск отравления.
3. Соблюдайте правила безопасного хранения и утилизации: Na2O необходимо хранить в закрытых контейнерах, вдали от прямых источников тепла и огня. При утилизации оксида натрия следует соблюдать все меры безопасности и сдавать его в специальные пункты приема опасных отходов.
4. Предоставьте доступ к информации: при работе с Na2O необходимо обучить персонал правилам безопасности и предоставить им всю необходимую информацию о вредных свойствах вещества, способах предотвращения аварийных ситуаций и оказания первой помощи в случае необходимости.
5. При необходимости обратитесь к медицинской помощи: в случае попадания Na2O на кожу или вдыхания его паров, необходимо сразу промыть пораженную область большим количеством воды и обратиться за медицинской помощью. Быстрая реакция поможет предотвратить возможные осложнения и максимально снизить воздействие оксида на организм.
Важно помнить: соблюдение мер предосторожности при работе с Na2O позволяет работать с этим оксидом безопасно и минимизировать возможные риски для здоровья. Дисциплинированное и ответственное отношение к правилам безопасности является ключевым фактором для предотвращения возможных несчастных случаев и сохранения здоровья сотрудников и окружающих.
Вопрос-ответ
Какое вещество представляет собой Na2O?
Na2O представляет собой оксид натрия, он образуется при взаимодействии натрия и кислорода.
Какие свойства имеет Na2O?
Na2O обладает свойствами щелочного оксида, то есть он реагирует с водой, образуя щелочь натрия. Также этот оксид является твердым веществом, имеет высокую температуру плавления и выделяет влагу при взаимодействии с водой.
В каких областях применяется Na2O?
Na2O является важным компонентом в различных отраслях промышленности. Он используется в производстве стекла, в качестве реагента в химической промышленности, а также в качестве ионного проводника в электрохимических устройствах.
Можно ли использовать Na2O в пищевой промышленности?
Na2O не рекомендуется использовать в пищевой промышленности, так как он является очень щелочным веществом и может вызвать ожоги или другие вредные эффекты при контакте с человеческой кожей или слизистыми оболочками.
Как находят применение оксиды в химической промышленности?
Оксиды, включая Na2O, находят широкое применение в химической промышленности как реагенты, катализаторы и материалы для синтеза различных веществ. Они играют важную роль во многих химических процессах, таких как синтез полимеров, производство лекарств и создание специализированных химических соединений.
Чем отличается Na2O от других оксидов?
Na2O отличается от других оксидов тем, что содержит атомы натрия и кислорода. Этот оксид имеет свойства щелочного оксида, который реагирует с водой, образуя щелочь натрия.
Как происходит образование оксида натрия?
Образование оксида натрия происходит при реакции натрия с кислородом. Атомы натрия окисляются, а атомы кислорода присоединяются к ним, образуя структуру Na2O.
