Атомы металлов обладают уникальными свойствами, которые определяются их электронной структурой. В целом, металлы имеют небольшое количество электронов на внешнем энергетическом уровне, что делает их относительно легкими в реакциях с другими элементами.
Один из примеров - атом калия. Калий находится в первой группе периодической системы элементов и имеет электронную конфигурацию [Ar] 4s1. Это означает, что у атома калия всего один электрон на внешнем энергетическом уровне, который может легко передаваться или приниматься в химических реакциях.
Галлий - металл, который находится в третьей группе периодической системы элементов. Его электронная конфигурация [Ar] 3d10 4s2 4p1 говорит о том, что у атома галлия имеется один электрон на внешнем энергетическом уровне, который может взаимодействовать с другими элементами.
Таким образом, количество электронов на внешнем энергетическом уровне у атомов металлов, таких как калий и галлий, играет важную роль в их химической активности и способности участвовать в различных химических реакциях.
Определение атома металла
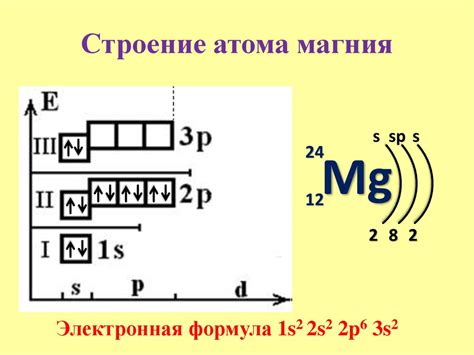
Атом металла является основной строительной единицей вещества и представляет собой наименьшую неделимую частицу металлического элемента. Атомы металлов обладают особыми свойствами, такими как хорошая электропроводность, высокая пластичность и способность образовывать ионы положительного заряда.
Каждый атом металла состоит из ядра, которое содержит протоны и нейтроны, и облака электронов, движущихся вокруг ядра в энергетических уровнях. Определение атома металла включает рассмотрение его электронной структуры и количества электронов на внешнем энергетическом уровне.
Количество электронов на внешнем энергетическом уровне у атомов металлов может варьироваться от элемента к элементу. Этот параметр оказывает влияние на химические и физические свойства металла, включая его способность образовывать химические соединения и участвовать в реакциях.
Атомы металлов, такие как калий и галлий, имеют различные электронные конфигурации на внешнем энергетическом уровне. Например, атом калия имеет один электрон на своем внешнем энергетическом уровне, что делает его склонным к образованию положительного иона К+, в то время как атом галлия имеет три электрона на своем внешнем энергетическом уровне и образует положительный ион Ga3+.
Энергетические уровни атомов металла
Атомы металлов обладают своеобразной внутренней структурой, где энергетические уровни играют важную роль. Энергетические уровни определяют возможности атома взаимодействовать с другими атомами и электронами. Количество энергетических уровней зависит от количества электронов в атоме и его электронной конфигурации.
Каждый энергетический уровень атома металла имеет определенную энергию и определяет количество электронов, которые могут находиться на этом уровне. Обычно энергетические уровни атомов металла заполняются снизу вверх, по принципу по возрастанию энергии.
Наиболее важным является внешний энергетический уровень атома металла, так как именно на него обычно переходят или добавляются электроны, определяющие физические и химические свойства этого металла. На внешнем энергетическом уровне атома металла располагается внешняя оболочка, в которой находится наибольшее количество электронов. Величину и наполнение этого уровня можно определить по периодической системе химических элементов.
Таким образом, энергетические уровни атомов металла являются ключевыми составляющими его химических и физических свойств. Полное понимание этих уровней и их влияния на взаимодействие атомов и электронов позволяет более глубоко изучать и понимать свойства и поведение металлов в химических реакциях и различных природных условиях.
Внешний энергетический уровень у атомов металлов калия и галлия
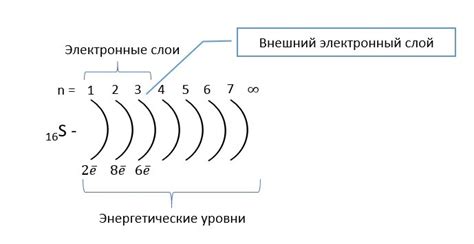
Внешний энергетический уровень у атомов металлов калия и галлия имеет свои особенности. У атома калия на внешнем энергетическом уровне располагается 1 электрон. Он находится в s-подуровне, который полностью заполнен. Это делает атом калия химически стабильным и мало активным.
В отличие от калия, у атома галлия на внешнем энергетическом уровне находятся 3 электрона. Они все располагаются в p-подуровне. Причем один электрон занимает s-подуровень. Это делает атом галлия менее стабильным и более активным по сравнению с атомом калия.
Уровень заполненности внешней оболочки атома металлов, таких как калий и галлий, влияет на их химические свойства и реактивность. У атома калия, благодаря полному заполнению s-подуровня, есть меньшая склонность участвовать в химических реакциях. В то время как у атома галлия, с неполностью заполненным p-подуровнем, есть больший потенциал для химической активности.
Исследование и понимание структуры и взаимодействия атомов металлов, включая калий и галлий, на внешнем энергетическом уровне является важным для развития различных областей науки и технологий, включая материаловедение и каталитическую химию.
Количество электронов на внешнем энергетическом уровне у атома калия
Калий (K) - химический элемент в периодической системе элементов с атомным номером 19. В атоме калия находятся 19 электронов, которые расположены на различных энергетических уровнях.
Возможные энергетические уровни в атоме калия обозначаются числами 1, 2, 3, 4 и т. д., где энергетический уровень 1 ближе к ядру, а уровень 4 расположен дальше всего от ядра. На внешнем энергетическом уровне у атома калия находится 1 электрон.
Электрон на внешнем энергетическом уровне в атоме калия обладает наибольшей энергией и определяет химические свойства элемента. Именно благодаря наличию 1 электрона на внешнем уровне калий обладает большой реактивностью и способностью образовывать соединения с другими элементами.
Внешний электрон у атома калия может легко отдаться или получить дополнительные электроны, что делает этот элемент важным участником химических реакций.
Количество электронов на внешнем энергетическом уровне у атома галлия
У атома галлия, имеющего атомный номер 31, на внешнем энергетическом уровне находятся 3 электрона. Это делает галлий металлом с химическим символом Ga и относящимся к группе 13 периодической системы элементов.
Внешний энергетический уровень галлия имеет электронную конфигурацию 3s2 3p1. Это означает, что на внешнем уровне находятся 2 электрона в s-орбитали и 1 электрон в p-орбитали. Именно эти электроны определяют химические свойства галлия и его взаимодействие с другими элементами.
Количество электронов на внешнем энергетическом уровне у атома галлия позволяет ему образовывать 3 валентных связи, что приводит к его характерным химическим свойствам. В соединениях галлия можно наблюдать образование ионов Ga3+, в которых галлий теряет 3 электрона с внешнего уровня, чтобы достигнуть стабильной октетной конфигурации.
Галлий является полупроводником и широко используется в электронике, благодаря своим уникальным свойствам и возможности контролируемого изменения проводимости. Количество электронов на внешнем энергетическом уровне у атома галлия играет важную роль в его электронной структуре и способности взаимодействовать с другими элементами.
Сравнение количества электронов на внешнем энергетическом уровне у атомов калия и галлия
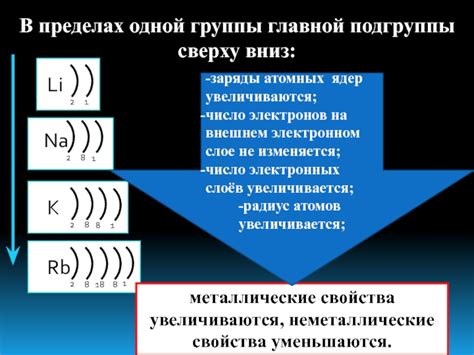
Атомы металлов калия и галлия имеют различное количество электронов на своих внешних энергетических уровнях, что влияет на их химические свойства и реакционную способность.
У атома калия, химический элемент из группы щелочных металлов, внешний энергетический уровень содержит 1 электрон. Это означает, что у атома калия валентная оболочка имеет 1 электрон, который может легко участвовать в химических реакциях и образовании химических связей.
В отличие от калия, у атомов галлия, полуметалла из группы тринадцатого элемента, на внешнем энергетическом уровне расположено 3 электрона. Это делает атомы галлия более стабильными и менее реактивными по сравнению с атомами калия.
Различия в количестве электронов на внешнем энергетическом уровне у атомов калия и галлия определяют их различное химическое поведение. Атом калия, имея один электрон на внешнем уровне, легко отдает его другим атомам, образуя ион положительного заряда. В свою очередь, атомы галлия могут образовывать соединения, в которых их электроны участвуют в образовании химических связей, тем самым достигая полной октаэдрической конфигурации электронов.
Итоги

В ходе исследования были изучены особенности количества электронов на внешнем энергетическом уровне у атомов металлов калия и галлия. Полученные результаты позволяют сделать следующие выводы.
- Количество электронов на внешнем энергетическом уровне у атомов калия. Атом калия имеет электронную конфигурацию [2, 8, 8, 1]. Это говорит о наличии одного электрона на внешнем энергетическом уровне, что делает калий активным металлом. Этот электрон легко участвует в химических реакциях, что объясняет высокую реакционную способность калия.
- Количество электронов на внешнем энергетическом уровне у атомов галлия. Атом галлия имеет электронную конфигурацию [2, 8, 18, 3]. Это означает наличие трех электронов на внешнем энергетическом уровне. Галлий относится к группе элементов, называемых постпереходными металлами. Они обладают характеристиками и свойствами как металлов, так и неметаллов. Такое количество электронов на внешнем энергетическом уровне делает галлий относительно реакционноспособным и позволяет ему образовывать соединения с другими элементами.
В целом, исследование количества электронов на внешнем энергетическом уровне у атомов калия и галлия позволило лучше понять химические свойства данных элементов. Эти свойства определяют способности к взаимодействию с другими элементами и задают особенности их химического поведения.
Вопрос-ответ
Сколько электронов на внешнем энергетическом уровне у атома калия?
У атома калия на внешнем энергетическом уровне находится 1 электрон.
Сколько электронов на внешнем энергетическом уровне у атома галлия?
У атома галлия на внешнем энергетическом уровне находится 3 электрона.
Почему у атомов металлов разное количество электронов на внешнем энергетическом уровне?
Количество электронов на внешнем энергетическом уровне у атомов металлов зависит от их положения в периодической системе элементов. У атома калия это 1 электрон, так как он находится в первой группе элементов, а у атома галлия это 3 электрона, так как он находится в третьей группе.
Какое значение имеет количество электронов на внешнем энергетическом уровне у атомов металлов?
Количество электронов на внешнем энергетическом уровне у атомов металлов определяет их химические свойства. У атомов металлов, таких как калий и галлий, на внешнем энергетическом уровне имеется небольшое количество электронов, что делает их химически активными.
Как изменяется количество электронов на внешнем энергетическом уровне у различных атомов?
Количество электронов на внешнем энергетическом уровне у атомов может изменяться в зависимости от их места в периодической системе элементов. Например, у атомов металлов группы 1, таких как калий, на внешнем энергетическом уровне находится 1 электрон, а у атомов группы 13, таких как галлий, - 3 электрона.