Электролиз водного раствора металлических солей является одним из основных способов получения металлов. Однако существуют металлы, которые невозможно получить этим методом из-за их свойств и структуры.
Первым таким металлом является алюминий. Алюминий, несмотря на широкое использование в промышленности и повседневной жизни, нельзя получить электролизом водного раствора его солей. Это связано с тем, что алюминий обладает высокой степенью окисления и образует оксидную пленку на своей поверхности, которая не позволяет электролитическому разложению алюминиевых ионов водой.
Еще одним примером является железо. Железо образует стабильные соединения, такие как ржавчина, которые также препятствуют электролизу водного раствора его солей. Кроме того, железо обладает различными степенями окисления, что также затрудняет его электролиз.
Ртути также невозможно получить электролизом водного раствора ее солей из-за ее высокой химической активности и способности формировать амальгамы с другими металлами. Ртуть может разлагать воду на водород и оксид ртути, но сама она не может быть получена электролизом водного раствора.
Таким образом, некоторые металлы, такие как алюминий, железо и ртуть, не могут быть получены электролизом водного раствора их солей из-за особых свойств их ионов и соединений. Однако существуют другие методы получения этих металлов, которые используются в промышленности и научных исследованиях.
Влияние электролита на процесс электролиза
При проведении электролиза водного раствора солей электролит играет важную роль, оказывая влияние на ход реакции и эффективность процесса. Электролит обладает способностью ионизироваться в растворе, поэтому его свойства и концентрация могут изменять скорость разложения ионов на электродах.
Выбор электролита влияет на два важных параметра процесса электролиза: скорость разложения вещества и состав покрытия на электродах. Некоторые металлы, такие как алюминий, магний, калий, натрий, литий, покрываются оксидным слоем, который дает им защитные свойства и предотвращает дальнейшее разложение. Однако, другие металлы, такие как железо или никель, не образуют стабильный оксидный слой и требуют дополнительных электролитов для увеличения скорости реакции и качества покрытия.
Кроме того, электролит может влиять на химические и физические свойства разложенного вещества. Например, вода может служить электролитом при электролизе солей, что приводит к образованию кислорода и водорода на электродах. При этом, концентрация солей и кислот в растворе может изменять степень разложения, а также определять состав и свойства полученных продуктов.
Для оптимальных результатов процесса электролиза необходимо тщательно подобрать электролит, учитывая особенности разлагаемого вещества и требуемую скорость реакции. Оптимальные условия можно достигнуть путем изменения концентрации электролита, температуры, давления и других параметров процесса.
Итак, электролит играет важную роль в процессе электролиза водного раствора солей, влияя на скорость разложения вещества, состав покрытия на электродах и свойства разложенного продукта. Подбор оптимального электролита является ключевым моментом для достижения эффективных результатов электролиза и получения требуемого вещества.
О катоде и процессе электролиза
Катод - это электрод, на котором происходит процесс восстановления вещества во время электролиза. На катоде происходит приём электронов и образование вещества с восстановленным зарядом. Катод является отрицательно заряженным электродом в электролитической ячейке.
Процесс электролиза - это химический процесс, при котором происходит разложение раствора вещества на положительные и отрицательные ионы под воздействием электрического тока. Во время электролиза на катоде осуществляется восстановление положительных ионов, а на аноде - окисление отрицательных ионов.
В процессе электролиза на катоде происходят различные типы реакций в зависимости от химического вещества, которое подвергается электролизу. Некоторые вещества могут восстанавливаться на катоде в свою первоначальную форму, например, металлы из их соответствующих положительных ионов. Однако существуют и такие металлы, которые невозможно получить электролизом водного раствора их солей.
При применении электролиза водного раствора для получения металлов возможностей ограничены. Некоторые металлы, такие как магний, алюминий и кальций, сильно связаны с кислородом и не могут быть восстановлены на катоде при электролизе водного раствора их солей. Вместо этого, электролиз водных растворов различных электролитов может приводить к образованию газов или других продуктов.
Таким образом, для получения некоторых металлов, невозможно использовать электролиз водного раствора их солей. Вместо этого, для получения этих металлов необходимо применять специальные методы или использовать другие виды электролитов, например, плавление солей или использование неизменяемых анодов.
Металлы, получаемые электролизом

Электролиз является одним из наиболее распространенных способов получения различных металлов. Этот процесс основан на использовании электродов, подключенных к источнику электрического тока, чтобы разложить соединения металла на ионы и получить его в чистом виде.
Один из самых популярных металлов, получаемых электролизом, - это алюминий. Для его производства используется процесс электролиза алюминийсодержащих руд, таких как бокситы. При этом на аноде образуется кислород, а на катоде - алюминий как металлическая плита.
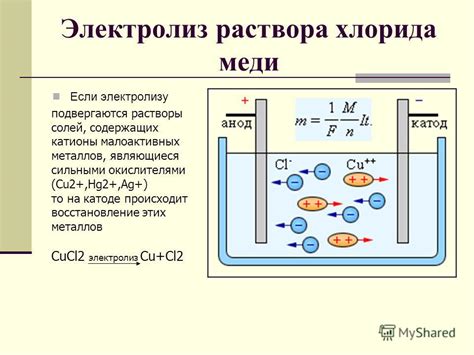
Другим металлом, который можно получить электролизом, является медь. В основном, процесс электролиза используется для получения меди из медных руд или концентратов. Путем электролиза раствора солей меди, на катоде образуется металлическая медь, а на аноде - кислород.
Некоторые редкие земли, такие как неодим или прахеодим, также можно получить с помощью электролиза. Для этого используются соответствующие растворы или сплавы, в которых происходит разложение соединений и получение желаемых металлов.
Электролиз широко применяется в производстве различных металлов, таких как никель, цинк, титан, свинец и т. д. Этот метод позволяет получать металлы с высокой степенью чистоты и контролируемыми свойствами, что делает его весьма эффективным для промышленного производства.
Особенности металлов, нелегко получаемых электролизом
Металлы, которые нельзя получить электролизом водного раствора их солей, имеют свои особенности. Одной из таких особенностей является высокая степень химической активности этих металлов. Такие металлы обладают сильной аффинностью к кислороду, что делает их неустойчивыми в водной среде и препятствует их получению электролизом.
Еще одной особенностью таких металлов является низкая степень адгезии к электродам. Несмотря на высокую плотность электрического тока, который проходит через электроды, эти металлы не сливаются с поверхностью электрода и остаются в растворе солей. Это создает сложности при их получении электролизом и требует применения специальных технологий и условий реакции.
Также отмечается, что металлы, нелегко получаемые электролизом, часто обладают высоким показателем электроотрицательности. Это значит, что они представляют собой сильные окислители и способны образовывать стабильные положительные ионы в водном растворе. В результате электролиза происходит образование газовых продуктов или взаимодействие с водой, что делает реакцию электролиза неэффективной для получения металла.
Для успешного получения металлов, нелегко электролизуемых, необходимо применять специальные методы осаждения и использовать адекватные условия реакции. Например, можно использовать инертные электроды или проводить электролиз в среде с низким содержанием кислорода. Такие модификации позволяют справиться с трудностями, связанными с получением этих металлов и обеспечить необходимую эффективность процесса.
Вопрос-ответ
Можно ли получить алюминий электролизом водного раствора его соли?
Нет, нельзя. Алюминий не может быть получен электролизом водного раствора его солей из-за его высокой степени окисления.
Почему нельзя получить кальций электролизом водного раствора его соли?
Кальций не может быть получен электролизом водного раствора его солей из-за его высокой степени окисления.
Какие металлы нельзя получить электролизом водного раствора их солей?
Некоторые металлы, такие как алюминий, кальций, магний и цинк, не могут быть получены электролизом водного раствора их солей из-за их высокой степени окисления.
Какие металлы нельзя получить электролизом водного раствора?
Некоторые металлы, такие как алюминий, кальций, магний и цинк, не могут быть получены электролизом водного раствора их солей из-за их высокой степени окисления.
Какие причины мешают получить алюминий электролизом водного раствора его соли?
Алюминий не может быть получен электролизом водного раствора его солей из-за его высокой степени окисления, что создает технические препятствия для этого процесса.
Почему магний невозможно получить электролизом водного раствора его соли?
Магний невозможно получить электролизом водного раствора его соли из-за его высокой степени окисления, что не позволяет произвести электролиз водного раствора его солей.
