Оксиды металлов являются одними из наиболее распространенных соединений металлов. Металлы могут образовывать различные оксиды, в том числе и трехвалентные оксиды типа Me2O3. Конфигурация валентного слоя показывает, как атомы металла и кислорода расположены друг относительно друга в структуре оксида.
При формировании оксида Me2O3, валентный слой образует трехсвязная кристаллическая структура. В ней атомы металла и кислорода расположены таким образом, что каждый атом металла соединен с тремя атомами кислорода и каждый атом кислорода соединен с тремя атомами металла.
Эта конфигурация валентного слоя образует структуру с трехмерным упорядоченным решетчатым строением. Такая структура обеспечивает стабильность оксида и его способность к образованию кристаллов с определенными физическими и химическими свойствами.
Трехвалентные оксиды типа Me2O3 широко применяются в различных областях, включая керамику, катализ и электронику. Их особенности и свойства определяются их конфигурацией валентного слоя, что делает изучение этой конфигурации важным аспектом в химии металлов и соединений.
Оксиды в химии
Оксиды представляют собой химические соединения, в которых кислород является отрицательным ионообразующим элементом. В зависимости от валентности металла, оксид может иметь различную степень окисления. В данном случае мы рассматриваем оксид Me2O3, где Me обозначает металл.
При формировании оксида Me2O3 металл обычно находится в валентном состоянии III. Таким образом, конфигурация валентного слоя будет соответствовать трехвалентному состоянию металла. Например, если Me обозначает железо (Fe), то оксид будет иметь формулу Fe2O3.
Металлы, образующие оксиды Me2O3, обычно принадлежат к группам переходных элементов Периодической системы. Эти оксиды могут иметь разнообразные физические и химические свойства, в зависимости от самого металла и условий его образования.
Оксиды выполняют важные функции в химических реакциях и промышленности. Они могут быть использованы в качестве катализаторов, пигментов, материалов для хранения энергии, а также применяться в процессах окисления и восстановления.
Свойства оксидов
Оксиды представляют собой соединения, состоящие из атомов кислорода, связанных с атомами других элементов. Они имеют широкий спектр свойств, которые зависят от состава и структуры конкретного оксида.
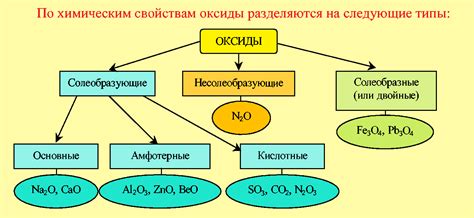
Первое характерное свойство оксидов - их кислотность или щелочность. Оксиды металлов обычно являются основаниями и образуют гидроксиды при реакции с водой. Примером такого оксида является оксид натрия (Na2O), который при контакте с водой образует щелочь натрия (NaOH). С другой стороны, оксиды неметаллов обычно являются кислотами и могут образовывать кислотные растворы при растворении в воде. Например, диоксид серы (SO2) образует сернистую кислоту (H2SO3) в водном растворе.
Второе важное свойство оксидов - их химическая активность. Она зависит от возможности оксида вступать во взаимодействие с другими соединениями. Некоторые оксиды обладают высокой активностью и могут вступать в химические реакции с большим количеством веществ. Такие оксиды часто используются в промышленности и в химической лаборатории.
Также стоит упомянуть о свойстве оксидов изменять физические свойства материалов. Например, оксиды металлов могут придавать специфические цвета стеклу или керамике. Они также могут быть использованы в качестве катализаторов, повышая скорость химических реакций, или в качестве противокоррозионных покрытий.
Оксиды металлов
Оксиды металлов представляют собой соединения, состоящие из металла и кислорода. Они образуются при взаимодействии металлов с кислородом воздуха или других окислителей. Оксиды металлов имеют широкий спектр свойств, которые зависят от конфигурации валентного слоя металла.
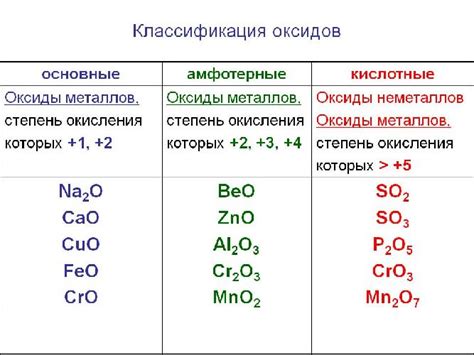
Один из наиболее распространенных типов оксидов металлов - оксиды валентности III, такие как Al2O3, Fe2O3, Cr2O3. В этих соединениях металл имеет валентность +3, а кислород -2. Такая конфигурация валентного слоя обеспечивает устойчивость оксидов металлов и их химическую активность.
Оксиды металлов обладают различными физическими и химическими свойствами. Например, оксид железа (Fe2O3) обладает красной окраской и называется гематитом. Он является одним из самых распространенных оксидов в земной коре и используется в качестве пигмента и добавки при производстве стали.
Оксиды металлов играют важную роль в различных отраслях промышленности. Они используются в производстве керамики, стекла, металлургии, электроники и других отраслях. Некоторые оксиды металлов обладают полупроводниковыми свойствами и используются в производстве полупроводниковых приборов.
Исследование оксидов металлов важно для понимания их свойств и разработки новых материалов с улучшенными характеристиками. Благодаря развитию научных и технологических методов, можно создавать оксиды металлов с определенными структурными и электронными свойствами, что позволяет расширить их применение в различных областях науки и промышленности.
Особенности образования оксида Me2O3
Формирование оксида Me2O3, где Me обозначает металлический элемент, связано с конфигурацией валентного слоя этих металлов. Оксид Me2O3 образуется при взаимодействии металла с кислородом и представляет собой соединение, в котором металл находится в трехвалентном состоянии.
Оксид Me2O3 может быть образован несколькими способами. Один из наиболее распространенных - это окисление металла при взаимодействии с кислородом в воздухе. Некоторые металлы образуют оксид Me2O3 спонтанно, как, например, оксид алюминия (Al2O3), который образуется при окислении алюминия.
Конфигурация валентного слоя металла определяет степень окисления атома металла при формировании оксида Me2O3. Из-за наличия трех валентных электронов у металла, оксид Me2O3 является стабильным соединением при комнатной температуре и обладает хорошей химической стабильностью.
Оксид Me2O3 также может образовываться при химических реакциях металла с кислотами или аммиаком. В результате таких реакций образуется соединение, содержащее металл, кислород и другие элементы. Оксид Me2O3 может иметь различную структуру, в зависимости от способа его образования и свойств металла.
Металл Me и его характеристики

Металл Me в контексте формирования оксида Me2O3 обладает определенными характеристиками.
Первоначально, стоит упомянуть валентный слой, который образует этот металл. Он имеет конфигурацию, характеризующуюся своим числом электронов и их распределением по энергетическим уровням.
В случае с оксидом Me2O3 это валентный слой, образующий трехвалентный оксид. Это значит, что металл Me в данном оксиде имеет три электрона на своем валентном слое.
Особенности характера металла Me могут быть связаны с его электроотрицательностью, которая определяет его способность вступать в химические реакции и образовывать соединения. Металл Me, в данном случае, является реакционноспособным и образует оксид Me2O3.
Также можно отметить, что металл Me обладает определенными физическими свойствами, такими как плавкость, твердость, проводимость электричества и тепла.
В заключение стоит отметить, что металл Me и его характеристики имеют важное значение при формировании оксида Me2O3, так как свойства этого металла определяют структуру и свойства оксида.
Процесс формирования оксида Me2O3
Оксид Me2O3 формируется при окислении металла Me до его трехвалентного состояния. Этот процесс происходит при воздействии кислорода на металлическую поверхность. Окисление металла может происходить при различных условиях, таких как высокая температура или давление, а также в присутствии катализаторов или электрического тока.
Образование оксида Me2O3 связано с тем, что один атом металла Me соединяется с тремя атомами кислорода, образуя трехвалентное соединение. В результате этой реакции образуется структура валентного слоя, в которой каждый металлический ион, перешедший в трехвалентное состояние, окружен тремя атомами кислорода. Такая конфигурация валентного слоя обеспечивает стабильность оксида Me2O3.
Стоит отметить, что оксид Me2O3 обладает рядом полезных свойств, таких как высокая степень стабильности, электропроводность и химическая инертность. Поэтому этот оксид широко применяется в различных областях, например, в качестве катализатора, в производстве электродов и в других технологических процессах.
Конфигурация валентного слоя металла в оксиде
При формировании оксида Me2O3 конфигурация валентного слоя металла имеет определенную структуру, которая оказывает влияние на свойства и химическую активность материала.
Одной из распространенных конфигураций валентного слоя в оксидах Me2O3 является гексагональная ближайшая упаковка. При такой упаковке атомы металла формируют гексагональную решетку, в которой каждый атом металла окружен шестью атомами кислорода.
Валентный слой металла в оксиде Me2O3 может также иметь кубическую плотную упаковку. При такой упаковке атомы металла располагаются в вершинах и центрах граней кубической кристаллической решетки, а атомы кислорода располагаются в центрах каждой грани.
Однако, валентный слой металла в оксиде Me2O3 может иметь и другие конфигурации, такие как тетрагональная или ромбическая решетки, в зависимости от специфических условий формирования оксида и свойств самого металла.
Таким образом, конфигурация валентного слоя металла в оксиде Me2O3 определяет его кристаллическую структуру и влияет на его свойства, такие как твердость, теплопроводность, электропроводность и другие характеристики, что делает ее важной для понимания и изучения оксидов металлов.
Вопрос-ответ
Какая конфигурация валентного слоя образуется при формировании оксида Me2O3?
При формировании оксида Me2O3 металл образует конфигурацию валентного слоя, где каждый металлический ион Me имеет окружение из шести атомов кислорода.
Какие атомы окружают металлический ион Me при формировании оксида Me2O3?
Атомы кислорода окружают металлический ион Me при формировании оксида Me2O3.
Сколько атомов кислорода окружают каждый металлический ион Me при формировании оксида Me2O3?
Каждый металлический ион Me окружают шесть атомов кислорода при формировании оксида Me2O3.
Какова структура оксида Me2O3?
Оксид Me2O3 имеет кристаллическую структуру, в которой каждый металлический ион Me окружен шестью атомами кислорода.
Какова координация металлического иона Me в оксиде Me2O3?
Металлический ион Me в оксиде Me2O3 имеет окружение из шести атомов кислорода, поэтому его координация равна шести.


