Гальваническая пара - это соединение двух разных металлов, которое образует электрохимическую ячейку. Взаимодействие разных металлов в гальванической паре приводит к тому, что один металл выступает в роли анода, а другой - в роли катода. Это приводит к электрохимическим процессам, в результате которых происходит передача электронов и образование потенциала. Правильное сочетание разных металлов в гальванической паре позволяет улучшить эффективность и устойчивость таких систем.
Выбор гальванической пары металлов играет важную роль при проектировании электрохимических систем, таких как аккумуляторы, гальванические элементы, а также при проведении коррозионных испытаний. Ведь каждый металл имеет свои химические и электрические свойства, которые влияют на электрохимическую реакцию в гальванической паре.
Наиболее эффективные гальванические пары металлов обладают следующими характеристиками: высокая разность потенциалов между металлами, низкая склонность к коррозии и образованию окислов, а также химическая и электрическая совместимость материалов.
Эффективное сочетание металлов в гальванической паре может использоваться для улучшения энергетической эффективности системы, защиты от коррозии или для создания электрохимических устройств. Важно помнить, что неправильное сочетание металлов может привести к обратным эффектам, таким как активная коррозия и разрушение материалов.
Понятие гальванических пар
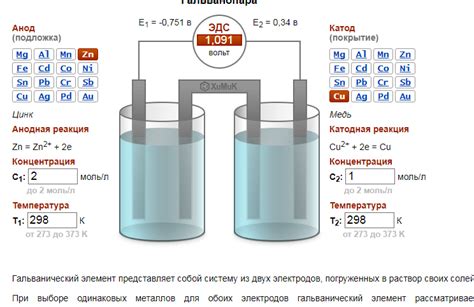
Гальваническая пара - это соединение двух различных металлов, образующее электрическую цепь при присутствии электролита. В такой паре один металл является анодом, а другой - катодом. Электрохимические свойства металлов позволяют использовать их в качестве электродов, создавая токовые цепи.
Изучение и правильное сочетание различных металлов в гальванических парах важно для разных областей науки и промышленности. Например, в области электрохимии гальванические пары используются для процессов гальванического покрытия, гальванического осаждения и электролиза.
Соединение металлов в гальванических парах приводит к возникновению разности электрического потенциала между ними. Эта разность потенциалов является основной причиной протекания электрохимических реакций в паре. При этом значимую роль играет электрохимическая активность металлов, которая определяется их способностью отдавать или принимать электроны.
Для успешного образования гальванической пары металлы должны быть правильно сочетаемыми. Оптимальная гальваническая пара состоит из металлов с разной электрохимической активностью - один металл должен быть активнее, а другой - менее активным. При этом активный металл будет являться анодом, а менее активный - катодом.
Возможности сочетания различных металлов
Гальванические пары металлов представляют собой сочетание двух металлических элементов, взаимодействие которых может быть как положительным, так и отрицательным. Правильный выбор сочетания металлов является важным фактором для достижения наилучших результатов в процессах гальванического покрытия и электрохимической обработки.
Одной из возможностей сочетания различных металлов является создание защитного покрытия, которое обеспечивает защиту от коррозии. Например, сочетание цинка и стали используется для создания гальванического цинкового покрытия, которое эффективно защищает сталь от коррозии.
Другой вариант сочетания металлов может быть использован для создания декоративных поверхностей с особыми эффектами. Например, сочетание меди и никеля способствует созданию прекрасной латунной отделки с золотистым оттенком.
Также возможно сочетание различных металлов для создания электрохимических элементов, таких как аккумуляторы и гальванические элементы. Например, сочетания свинца и свинцовых соединений с другими металлами позволяют создавать эффективные гальванические элементы.
Необходимо учитывать, что при сочетании различных металлов важно учитывать их электрохимические свойства и наличие гальванической серии металлов. Правильное сочетание металлов позволяет достичь наилучших результатов в процессах гальванического покрытия и электрохимической обработки, обеспечивая эффективность и долговечность материалов.
Основные принципы подбора гальванических пар

Один из основных принципов подбора гальванических пар металлов - это определение их электрохимического потенциала. Электрохимический потенциал каждого металла характеризует его способность вступать в окислительно-восстановительные реакции. Чем больше потенциал, тем больше его способность к окислению.
Подбирая гальваническую пару, необходимо учитывать их электрохимические потенциалы. Обычно металлы с более высоким потенциалом считаются анодами, а металлы с более низким потенциалом - катодами. Важно помнить, что при взаимодействии металлов в гальванической паре, анод будет подвергаться растворению, а катод будет выполнять роль защиты.
Другой принцип подбора гальванических пар связан с их электрохимической активностью. Электрохимическая активность металла зависит от его химической структуры и физических свойств. Металлы с большей электрохимической активностью обладают большей склонностью к окислению и растворению, поэтому их лучше использовать в качестве анодов. Металлы с меньшей активностью могут служить катодами.
Также при подборе гальванических пар необходимо учитывать их схожесть по химическому составу. Металлы, имеющие похожий химический состав, лучше сочетаются в гальванической паре. Это связано с их схожими химическими свойствами и поведением в реакциях окисления и восстановления.
Наконец, подбор гальванических пар также зависит от требований к конечному продукту и его использованию. Некоторые металлы могут использоваться для достижения определенных электрохимических или физических свойств, например, для защиты от коррозии, создания электролитических растворов или для оловения металлических изделий.
Лучшие гальванические пары металлов: примеры
Золото и платина: Эта пара металлов является одной из наиболее эффективных гальванических пар. Оба металла являются благородными металлами и обладают высокой стабильностью и низкой склонностью к коррозии. На них можно создать прочные и долговечные покрытия, которые обладают высокой эстетической привлекательностью.
Алюминий и нержавеющая сталь: Эта пара металлов обладает хорошей гальванической совместимостью. Алюминий является активным металлом, а нержавеющая сталь – пассивным. При сочетании этих металлов образуется защитная пленка оксида алюминия, которая предотвращает коррозию обоих материалов.
Железо и цинк: Эта пара металлов является классическим примером гальванической коррозии. При соединении железа и цинка, влага и наличие электролита (например, соли) приводят к образованию гальванической пары. Цинк будет действовать как анод и потеряет электроны, при этом железо будет выступать в роли катода и останется неизменным. Это приводит к разрушению цинка и защитному действию на железо.
Медь и никель: Эта пара металлов также является хорошей гальванической парой. Медь и никель обладают схожими потенциалами, что способствует образованию устойчивой пленки меди на поверхности никеля, предотвращающей коррозию и повышающей эстетическую привлекательность изделия.
В таблице ниже представлены примеры лучших гальванических пар металлов:
| Металл 1 | Металл 2 |
|---|---|
| Золото | Платина |
| Алюминий | Нержавеющая сталь |
| Железо | Цинк |
| Медь | Никель |
Важно учитывать, что гальваническая совместимость металлов может быть влиянием других факторов, таких как температура, химические соединения и особенности среды, в которой находятся металлы. При разработке гальванических покрытий и соединений металлов необходимо учитывать эти факторы для обеспечения максимальной эффективности и долговечности изделий.
Как правильно сочетать разные металлы: советы и рекомендации

Выбор правильной гальванической пары металлов может существенно влиять на эффективность и прочность конструкции. Какие металлы стоит сочетать, чтобы избежать коррозии и обеспечить хорошую электропроводность?
Во-первых, необходимо учитывать электрохимический ряд металлов. Металлы, находящиеся выше в этом ряду, имеют более высокий электроотрицательность, и они будут давать электроны металлам, находящимся ниже. Поэтому, лучше всего сочетать металлы, которые находятся рядом друг с другом в электрохимическом ряду.
Например, алюминий и цинк являются соседними металлами в электрохимическом ряду, поэтому гальваническая пара из этих металлов будет стабильной и не будет провоцировать коррозию.
Во-вторых, необходимо учитывать физические свойства металлов. Их коэффициенты теплового расширения могут варьироваться, что может привести к расслоению или повреждению конструкции. Поэтому, лучше сочетать металлы с близкими коэффициентами теплового расширения.
Кроме того, для обеспечения надежного сочетания металлов, рекомендуется использовать промежуточные слои или покрытия. Это поможет снизить возможность коррозии и улучшить адгезию между металлами. Также можно использовать различные антикоррозионные покрытия, такие как гальваническое оцинкование или анодирование.
В заключение, правильное сочетание гальванических пар металлов является важным аспектом при проектировании и создании металлических конструкций. Учитывайте электрохимический ряд, физические свойства металлов и используйте дополнительные методы защиты от коррозии.
Практическое применение гальванических пар металлов
Гальванические пары металлов нашли широкое практическое применение в различных отраслях. Одним из основных примеров использования является гальваническое покрытие металлами, которое применяется в производстве электроники, автомобилестроении и других отраслях, где требуется защита поверхности от коррозии или улучшение эстетического вида.
Гальваническое покрытие достигается путем соединения двух металлов в гальванической ячейке, где один металл выступает как анод, а другой – как катод. Процесс электролиза проводится с использованием электролита, который содержит соединения металла, применяемого для покрытия.
Примером практического применения гальванических пар металлов является гальваническое никелирование, которое применяется для защиты поверхности металлических деталей от окисления и коррозии. Также гальванические пары металлов используются в процессе хромирования, цинкования, меднения и других видов покрытия, которые служат для улучшения функциональных свойств деталей и их внешнего вида.
Кроме того, гальванические пары металлов находят применение в процессе производства аккумуляторных батарей. Здесь одним из наиболее распространенных примеров является использование гальванической пары свинец-свинец окись в свинцово-кислотных аккумуляторах. В таких аккумуляторах происходит электрохимическая реакция между металлическим свинцом и свинцовой окисью при зарядке и разрядке, что обеспечивает переход электроэнергии в химическую и обратно.
Подводя итог: важность правильного сочетания гальванических пар

Выбор правильной гальванической пары металлов является важным аспектом при создании различных электрических устройств. От правильного сочетания металлов зависит не только эффективность работы, но и долговечность системы.
Каждый металл имеет свою электрохимическую активность, которая может влиять на процессы окисления и восстановления, происходящие в паре. Неправильное сочетание металлов может привести к коррозии и разрушению системы.
Гальванические пары можно классифицировать на основе электрохимической серии металлов. Некоторые металлы, такие как золото и платина, являются инертными и могут сочетаться с другими металлами без проблем. Однако, некоторые металлы сильно разница знаков напряжений. Что может привести к возникновению гальванической коррозии.
Правильная комбинация металлов может помочь избежать гальванической коррозии и улучшить работу электрического устройства. Оптимальный подбор гальванической пары может увеличить энергетическую эффективность системы и продлить ее срок службы.
Вопрос-ответ
Какие металлы лучше всего сочетать в гальванической паре?
В гальванической паре лучше всего сочетать металлы, которые находятся рядом друг с другом в электрохимическом ряду. Такие металлы образуют более стабильные и эффективные гальванические пары.
Можно ли сочетать любые металлы в гальванической паре?
Теоретически, можно сочетать любые металлы в гальванической паре. Однако, при сочетании металлов, которые находятся далеко друг от друга в электрохимическом ряду, может возникать большое напряжение между ними, что может привести к ухудшению электрической цепи и коррозии металлов.
Какой металл лучше всего использовать как анод?
Лучше всего использовать в качестве анода металл, который находится выше другого металла в электрохимическом ряду. Такой металл будет активнее и будет уступать электроны другому металлу, что позволит предотвратить коррозию и сохранить катод в безопасности.
Какие примеры гальванических пар металлов можно привести?
Примерами гальванических пар металлов являются сочетания меди и цинка, железа и меди, алюминия и железа. В этих парах один металл будет выступать в качестве анода, а другой - в качестве катода.
Как правильно сочетать металлы в гальванической паре для защиты от коррозии?
Для защиты от коррозии необходимо сочетать металлы таким образом, чтобы один из них был активнее, а другой - менее активен. Активный металл будет выступать в качестве анода и вместо себя будет корродироваться, предотвращая коррозию менее активного металла, который будет выступать в качестве катода.

