Контрольная работа по теме "Щелочные металлы" представляет собой задание, которое акцентирует внимание на изучении основных свойств и характеристик этой группы химических элементов. Щелочные металлы, включающие литий, натрий, калий, рубидий, цезий и франций, являются самыми активными и химически реактивными металлами в периодической системе.
В ходе контрольной работы студентам будет предложено решить различные задачи, проверяющие их знания о физических и химических свойствах щелочных металлов. Это может включать в себя определение периодической системы элементов, составление уравнений реакций щелочных металлов с другими веществами, анализ реакционных условий и результатов исследований в лаборатории.
Важно отметить, что щелочные металлы имеют много областей применения в различных отраслях науки и промышленности. Например, они используются в производстве щелочных батарей, стекла, порошков для пожаротушения и многих других продуктах. Поэтому знание свойств и связей между щелочными металлами и другими веществами имеет большое значение для молодых химиков и научных работников.
Таким образом, выполнение контрольной работы по теме "Щелочные металлы" позволит студентам закрепить свои знания и развить навыки работы с химическими реакциями. Это даст возможность применить полученные знания на практике и способствовать дальнейшему освоению химической науки.
Определение щелочных металлов
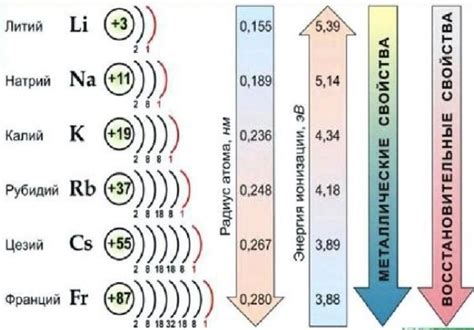
Щелочные металлы - группа химических элементов, которые относятся к сильным основаниям и образуют щелочные растворы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Определение щелочных металлов можно провести с помощью нескольких характеристик. Во-первых, щелочные металлы образуют ионы с положительным зарядом, которые имеют наименьшую ионизационную энергию среди всех элементов. Также они обладают низкой электроотрицательностью, что делает их хорошими ионогенами.
Одной из важных особенностей щелочных металлов является их активность. Они реагируют с водой, кислородом и другими элементами, образуя различные соединения. Реакция щелочных металлов с водой включает выделение водорода и образование гидроксида щелочного металла. Это явление известно как щелочное гашение.
Щелочные металлы также имеют низкую плотность, низкую температуру плавления и кипения, а также малую твердость и прочность. Они обладают хорошей электропроводностью и используются в производстве аккумуляторов, сплавов и других промышленных материалов.
Стоит отметить, что франций является самым редким и радиоактивным элементом среди щелочных металлов. Его применение ограничено из-за его высокой токсичности и короткого срока жизни.
Физические свойства щелочных металлов
Щелочные металлы – это группа элементов, которые находятся в первой группе периодической таблицы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют ряд характеристических физических свойств, которые определяют их поведение и применение в различных отраслях науки и техники.
Во-первых, щелочные металлы характеризуются низкой плотностью. Плотность этих элементов постепенно увеличивается от лития до франция и составляет от 0,534 г/см³ для лития до 1,87 г/см³ для цезия. Низкая плотность позволяет щелочным металлам плавать на поверхности воды, и некоторые из них, такие как литий и натрий, реагируют с водой, образуя газ, который поднимается в воздух и образует яркую пламенную реакцию.
Во-вторых, щелочные металлы обладают низкой температурой плавления и кипения. Температура плавления этих элементов составляет от 179 градусов Цельсия для лития до 301 градуса Цельсия для цезия. Это означает, что щелочные металлы легко переходят из твердого состояния в жидкое при нагревании, что делает их удобными для использования в различных технологических процессах.
Кроме того, щелочные металлы обладают высокой электропроводностью. Эксперименты показывают, что электропроводность щелочных металлов является наиболее высокой среди всех элементов периодической таблицы. Это связано с тем, что щелочные металлы обладают одной электронной оболочкой, которая легко участвует в химических реакциях и может свободно двигаться в кристаллической решетке металла.
В целом, физические свойства щелочных металлов определяют их уникальные характеристики и широкое применение в различных областях науки и техники.
Химические свойства щелочных металлов
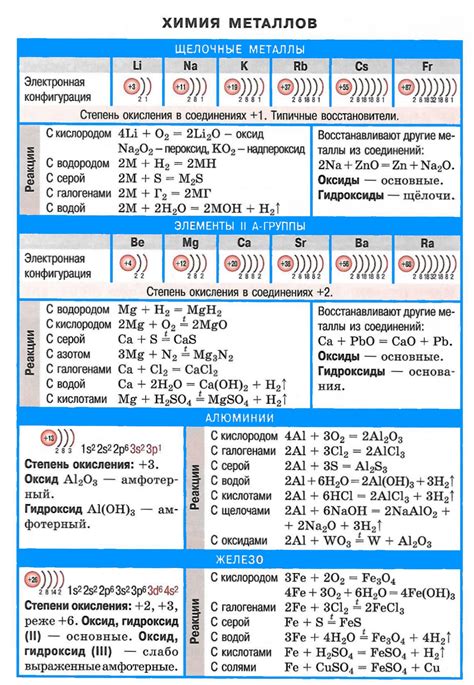
Щелочные металлы – группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они обладают рядом характерных химических свойств, определяющих их положение в системе.
Одной из основных характеристик щелочных металлов является их высокая реактивность. Благодаря низкой ионизационной энергии, они активно взаимодействуют с другими веществами. Например, при контакте с кислородом они горят с ярким пламенем, образуя оксид. Ученый можно сказать что это элемент кислородосодержащей атмосферы, горящего щелочного металл лития, реагирует непосредственно с азотом, образуя азид.
Также щелочные металлы активно взаимодействуют с водой и образуют щелочные растворы. При этом выделяется водород и образуется щелочное гидроксидное соединение. Подробности о реакции взаимодействия веществ можно найти в таблице.
| Элемент | Уравнение реакции |
|---|---|
| Литий (Li) | 2Li + 2H₂O → 2LiOH + H₂ |
| Натрий (Na) | 2Na + 2H₂O → 2NaOH + H₂ |
| Калий (K) | 2K + 2H₂O → 2KOH + H₂ |
| Рубидий (Rb) | 2Rb + 2H₂O → 2RbOH + H₂ |
| Цезий (Cs) | 2Cs + 2H₂O → 2CsOH + H₂ |
| Франций (Fr) | 2Fr + 2H₂O → 2FrOH + H₂ |
Щелочные металлы также проявляют способность образовывать соли. Их ионы имеют положительный заряд и образуют ионные соединения с отрицательно заряженными анионами. Благодаря этому свойству щелочные металлы широко используются в различных сферах, включая промышленность, медицину и научные исследования.
Применение щелочных металлов
Щелочные металлы – это группа химических элементов, включающая литий, натрий, калий, рубидий, цезий и франций. Они обладают высокой реактивностью и широко используются в различных областях.
Литий находит применение в производстве легких аккумуляторов, сплавов с алюминием и магнием, а также в фармацевтической и стекольной промышленности. Он является необходимым элементом в производстве лекарств для лечения биполярного расстройства и депрессии.
Натрий используется в производстве щелочных батарей, кожи и стекла. Он также важен для поддержания баланса электролитов в организме и регулирования давления крови. Натрий является ключевым компонентом пищевых добавок, таких как соль.
Калий применяется в сельском хозяйстве как удобрение для повышения урожайности и качества растений. Он также играет важную роль в поддержании здоровья сердца и функции нервной системы.
Рубидий используется в научных исследованиях, в производстве фотоэлементов и лазеров, а также в производстве специальных стекол и электронных компонентов.
Щелочные металлы также находят применение в ядерной энергетике, производстве пиротехники, химической промышленности, производстве сплавов и многих других отраслях.
Вопрос-ответ
Какие элементы входят в группу щелочных металлов?
В группу щелочных металлов входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие основные свойства характеризуют щелочные металлы?
Щелочные металлы обладают следующими основными свойствами: низкой плотностью, мягкостью, низкой температурой плавления и кипения, высокой реактивностью, способностью образовывать ионы с положительным зарядом.
Какая реакция происходит между щелочными металлами и водой?
Щелочные металлы реагируют с водой, образуя щелочные растворы и водород. Например, реакция натрия (Na) с водой протекает следующим образом: 2Na + 2H2O → 2NaOH + H2.
Какие соединения образуют щелочные металлы с кислородом?
Щелочные металлы образуют соединения с кислородом, называемые щелочными оксидами. Например, оксид натрия (Na2O) и оксид калия (K2O) являются щелочными оксидами.
Какие использования имеют щелочные металлы в повседневной жизни?
Щелочные металлы имеют различные использования в повседневной жизни. Например, натрий применяется в производстве стекла и щелочей, калий используется в производстве удобрений, а литий используется в производстве аккумуляторов.

