Глава 11 учебника Габриеляна по химии 9 класса посвящена изучению химических свойств металлов. Металлы являются одной из основных групп веществ и имеют ряд характерных свойств, которые делают их уникальными и важными для нашей жизни и промышленности.
Одним из наиболее известных характеристик металлов является их способность проводить ток электричества. Этот факт объясняется особенностями строения атомов металлов, которые обладают свободными электронами в своей внешней оболочке. Именно эти свободные электроны и обеспечивают проводимость тока в металлах.
Другим важным характеристикой металлов является их способность образовывать ионы положительного заряда. При химических реакциях металлы могут терять свои электроны, образуя положительно заряженные ионы. Это делает металлы активными химическими элементами, способными участвовать во многих реакциях и образовывать соединения с другими веществами.
Кроме того, металлы обладают высокой тепло- и электропроводностью, высокой пластичностью и тугоплавкостью. Они образуют кристаллическую решетку, которая обеспечивает их прочность и устойчивость. Эти свойства металлов являются важными для таких отраслей промышленности, как машиностроение, электротехника, строительство и многие другие.
В главе 11 учебника Габриеляна также рассматриваются свойства отдельных металлов, таких как железо, алюминий, медь, свинец и др. Описывается их взаимодействие с кислородом, кислотами, щелочами и другими веществами. Также изучаются способы получения металлов и их применение в различных отраслях промышленности.
Глава 11 "Химические свойства металлов" из учебника Габриеляна: конспект по химии 9 класс
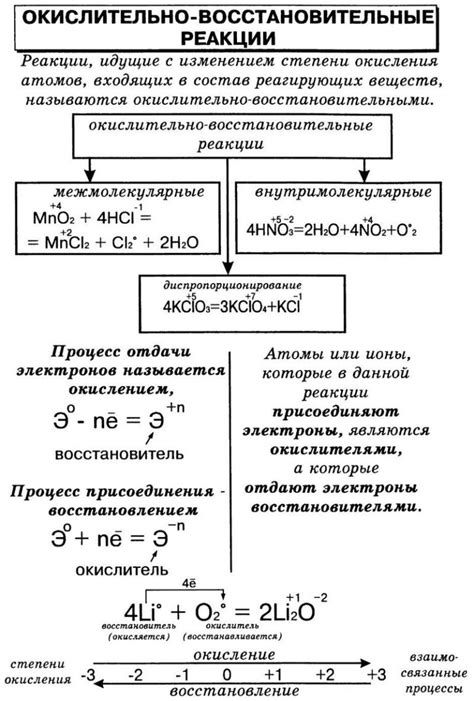
11.1. Химические свойства металлов
Металлы обладают рядом характерных химических свойств. Они вступают в реакции с кислородом, образуя оксиды металлов. Эти оксиды обычно являются основаниями и могут растворяться в воде, образуя щелочи. Металлы также обладают способностью взаимодействовать с неактивными неметаллами, такими как водород и азот, образуя соединения, которые проявляют кислотные свойства. Некоторые металлы способны реагировать с активными неметаллами, такими как хлор и фтор, образуя соли металлов.
11.2. Реакция металлов с кислотами
Металлы взаимодействуют с кислотами, образуя соли и выделяя водород. При этом происходит окисление металла и восстановление водорода. Реактивность металлов с кислотами зависит от того, как они расположены в ряду активности. Наиболее реактивные металлы, такие как щелочные металлы, быстро реагируют с кислотами, выделяя большое количество водорода. Менее реактивные металлы, такие как серебро и золото, могут не реагировать с некоторыми кислотами вообще.
11.3. Реакция металлов с водой
Некоторые металлы реагируют с водой, образуя соответствующие оксиды и выделяя водород. Эта реакция называется реакцией металлов с водой. Реактивность металлов с водой также зависит от их положения в ряду активности. Наиболее реактивные металлы, такие как щелочные металлы, реагируют с водой очень активно, выделяя большое количество водорода и образуя щелочи. Менее реактивные металлы, такие как железо и алюминий, реагируют с водой с трудом и образуют оксиды металлов.
11.4. Реакция металлов с солями
Металлы реагируют с солями, образуя новые соединения - соли. При этом происходит обмен металлов, то есть металл из соли вытесняет другой металл из его соли. Эта реакция называется реакцией вытеснения. Реактивность металлов в реакции с солями также зависит от их положения в ряду активности. Наиболее реактивные металлы, такие как щелочные и щелочноземельные металлы, могут вытеснить из солей практически все другие металлы. Менее реактивные металлы, такие как железо и цинк, могут вытеснить только определенные металлы из их солей.
Взаимодействие металлов с водой и кислородом
Металлы являются активными элементами, и их реакции с водой и кислородом проявляются в различных формах.
Металлы первой группы, такие как натрий (Na) и калий (K), реагируют с водой, образуя гидроксиды и выделяя водород. Кроме того, эти металлы изначально покрыты оксидной пленкой, которая предотвращает их дальнейшее окисление при взаимодействии с кислородом.
Металлы второй группы, как магний (Mg) и цинк (Zn), также реагируют с водой, но намного медленнее, чем металлы первой группы. В результате образуется гидроксид металла и выделяется водород.
Металлы третьей группы, такие как алюминий (Al) и жалезо (Fe), не реагируют с водой, но могут реагировать с гидроксидами, образуя соответствующие соли. При взаимодействии с кислородом, эти металлы окисляются, образуя оксиды или гидроксиды.
Металлы четвертой группы, например, свинец (Pb) и жесть (Sn), не реагируют с водой или кислородом при обычных условиях. Однако они могут проявлять активность в более экстремальных условиях, например, при высокой температуре или в присутствии кислорода с высокой активностью.
Таким образом, взаимодействие металлов с водой и кислородом зависит от их химических свойств и может приводить к образованию гидроксидов, солей и оксидов, а также выделению водорода. Эти реакции являются основой для понимания химических свойств металлов и их использования в различных промышленных и научных процессах.
Реакция металлов с кислотами и щелочами
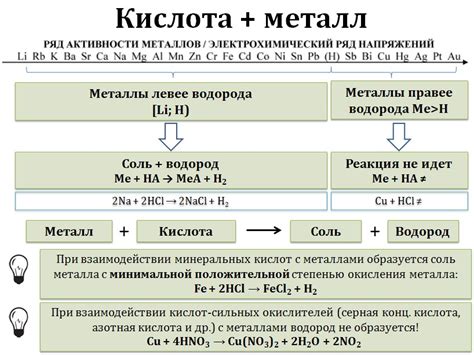
Металлы обладают способностью реагировать с кислотами и щелочами, что является одним из характерных свойств этих элементов. Реакция металлов с кислотами происходит с образованием солей и выделением водорода. Это связано с тем, что металлы активнее водорода и способны вытеснить его из кислотной среды.
Кроме образования солей, реакция металлов с кислотами сопровождается выделением водорода. Выделение водорода может протекать настолько интенсивно, что его горение можно наблюдать. При этом, для некоторых металлов, реакция с кислотами протекает со столь высокой интенсивностью, что ведет к разрушению приборов и оборудования.
Реакция металлов с щелочами происходит с образованием солей и выделением водорода. Обычно металлы соли при взаимодействии с щелочами растворяются в воде. Однако, некоторые металлы выступают в роли амфотерных оксидов, то есть они могут реагировать и с кислотами, и с щелочами. Примером такого металла является алюминий.
Вопрос-ответ
Какие химические свойства обладают металлы?
Металлы обладают рядом химических свойств: высокой теплопроводностью, электропроводностью, пластичностью и хорошей деформируемостью.
Что такое окисление металлов?
Окисление металлов - это процесс соединения металлов с кислородом. В результате окисления, формируется оксид металла.
Что такое общая реакция металла с кислородом?
Общая реакция металла с кислородом выглядит следующим образом: Металл + Окислитель (кислород) = Оксид металла.
Почему металлы реагируют с водой?
Металлы реагируют с водой из-за того, что вода содержит растворенные в ней ионы водорода H+. Металлы, которые способны реагировать с водой, могут вытеснить водород из молекулы воды и образовать гидроксиды металлов.
Что такое гидроксид металла?
Гидроксид металла - это соединение металла с гидроксильной группой OH-. Они образуются в результате реакции металла с водой или щелочью.
Какие металлы реагируют с кислотами?
Металлы, которые находятся низже в ряду двойных замещений, реагируют с кислотами. В результате реакции образуется соль и выделяется водород.
