В химии существует множество различных оксидов, некоторые из которых могут быть восстановлены водородом до свободного металла. Однако есть и такие оксиды, которые не способны быть восстановлены до металлического состояния при стандартных условиях. Эти оксиды обладают особыми свойствами и находят широкое применение в различных областях науки и техники.
Один из таких оксидов - оксид алюминия (Аl2O3). Этот соединение имеет высокую температуру плавления и кислотность. При нагревании оксид алюминия не восстанавливается водородом до алюминия. Оксид алюминия является одним из основных компонентов глины и используется в качестве прочного и стойкого материала в строительстве, производстве керамики и фармацевтической промышленности.
Еще одним примером такого оксида является оксид железа (Fe2O3), также известный как гематит. Данный оксид обладает высокой степенью окисления железа и не может быть восстановлен до металлического железа водородом при стандартных условиях. Оксид железа широко используется в производстве красителей, косметики и катализаторов.
Таким образом, оксиды, не поддающиеся восстановлению водородом до свободного металла при стандартных условиях, являются важными соединениями с уникальными свойствами и применением. Их изучение и использование в различных сферах научных и технических исследований является актуальной задачей и приносит важные результаты и открытия.
Оксиды, не восстанавливающиеся водородом до свободного металла
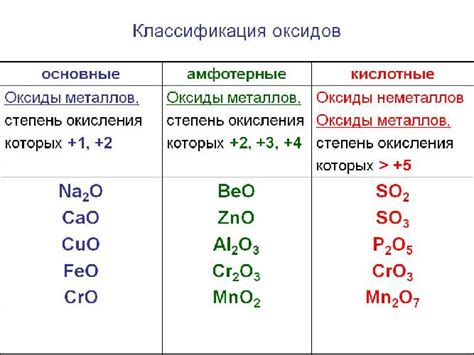
Оксиды, которые не могут быть восстановлены водородом до свободного металла при стандартных условиях, представляют особый интерес для науки и промышленности. Эти оксиды обладают высокой стабильностью и силой связи, что делает их невосприимчивыми к водородной редукции.
Один из представителей таких оксидов - оксид алюминия (Al2O3), известный под названием алюминиевый оксид или карриозин. Он является одним из самых распространенных оксидов в природе и имеет широкое применение в различных отраслях промышленности. Алюминиевый оксид обладает высокой термической и химической стабильностью, что делает его неуязвимым для воздействия водорода.
Другим примером оксида, не восстанавливающегося водородом до свободного металла, является оксид никеля (NiO). Никелевый оксид используется в различных технологических процессах, включая производство никелевых сплавов, а также в качестве катализатора в химической промышленности. Оксид никеля обладает высокой степенью окисления и силой связи, что делает его невосстанавливаемым водородом при стандартных условиях.
Такие оксиды, не поддающиеся восстановлению водородом, являются важными объектами исследований, направленных на поиск новых методов синтеза и модификации материалов, а также разработку эффективных катализаторов. Изучение и понимание химических свойств этих оксидов позволяет расширить наши знания о структуре и свойствах материалов, а также рассмотреть новые возможности их применения в различных областях науки и техники.
Оксиды, которые невозможно восстановить водородом до металлического состояния
Оксиды являются соединениями, состоящими из кислорода и других элементов. Взаимодействуя с водородом, некоторые оксиды могут быть восстановлены до свободного металла, однако существуют и такие оксиды, которые невозможно превратить в металл при стандартных условиях.
Одним из таких оксидов является оксид алюминия (Al2O3), более известный как алюминиевый оксид или корунд. Данный оксид обладает высокой стабильностью и имеет ковкую и прочную структуру. Восстановление алюминиевого оксида водородом до металла сопряжено с большой энергетической затратой, что делает процесс неэффективным при стандартных условиях.
Еще одним нередуцируемым оксидом является оксид меди (CuO). Медный оксид используется в различных областях, включая химическую и электротехнику. Однако восстановление медного оксида водородом до металла требует высоких температур и неприемлемо высоких концентраций водорода.
Также следует отметить оксид железа (Fe2O3), известный как оксид железа(III) или гематит. Помимо своего распространенного использования в качестве пигмента, оксид железа является нередуцируемым водородом оксидом при стандартных условиях.
В заключение, существуют определенные оксиды, которые невозможно восстановить водородом до металлического состояния при стандартных условиях. Эти соединения обладают высокой стабильностью и требуют значительных энергетических затрат для их редукции, что делает их неактивными в отношении водорода.
Оксиды, которые не могут быть превращены в металл в результате взаимодействия с водородом
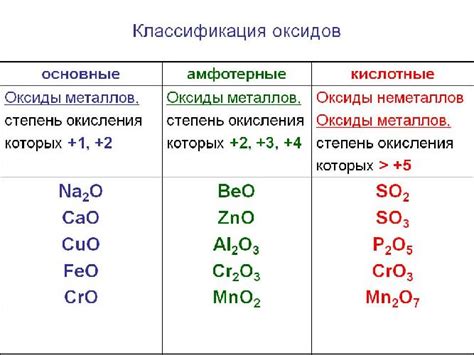
Оксиды – это химические соединения, которые состоят из химического элемента и кислорода. Взаимодействие оксидов с водородом может привести к различным реакциям, но есть определенные оксиды, которые не могут быть превращены в металл при стандартных условиях.
Один из таких оксидов – оксид алюминия (Al2O3). Этот оксид образуется путем окисления алюминия и является одним из самых распространенных минералов на Земле. Взаимодействие оксида алюминия с водородом при стандартных условиях не приводит к образованию свободного алюминия, так как этот процесс требует высоких温度 и специального оборудования.
Еще одним примером является оксид кремния (SiO2). Кремнезем – одна из самых распространенных минеральных форм кремния, и его оксид непрост в превращении в металл. При взаимодействии оксида кремния с водородом не происходит образования свободного кремния при стандартных условиях, так как данный процесс требует энергии и специализированного оборудования.
Также стоит отметить оксид меди (CuO), который образуется при окислении меди. Взаимодействие оксида меди с водородом не приводит к превращению в металл при стандартных условиях. Для получения свободной меди из оксида меди требуется применение физических или химических методов.
Все вышеупомянутые оксиды являются важными химическими соединениями, но их превращение в металл требует дополнительных условий и особых процессов. Необходимость использования специфических методов для получения свободного металла из данных оксидов делает их интересными объектами исследований в области химии и материаловедения.
Оксиды, устойчивые к восстановлению водородом до металлического состояния
Оксиды – это соединения, состоящие из атомов кислорода и другого химического элемента. Некоторые оксиды являются устойчивыми и не могут быть восстановлены водородом до металлического состояния при стандартных условиях.
Такие оксиды представляют собой сильные окислители и обладают высокой энергией связи между атомами кислорода и другим элементом. Они часто используются в промышленности и научных исследованиях благодаря своим уникальным свойствам.
Один из примеров таких оксидов – оксид азота (NO2). Этот соединение имеет красновато-коричневый цвет и характерный запах. Оно обладает высокой степенью окислительной активности и активно участвует в множестве химических реакций.
Еще одним примером является оксид азота (NO). Он обладает своеобразными свойствами, так как является важным компонентом атмосферы Земли. Оксид азота выполняет роль важного регулятора климата и окружающей среды, а также является важным компонентом в производстве азотной кислоты и других химических соединений.
Другим примером устойчивого к восстановлению водородом оксида является оксид углерода (CO2). Этот газ в значительной степени влияет на изменение климата и является основным газом, вызывающим парниковый эффект.
Таким образом, оксиды, которые не могут быть восстановлены водородом до металлического состояния при стандартных условиях, играют важную роль в химии и промышленности, а также влияют на окружающую среду и климат планеты.
Оксиды, не поддающиеся восстановлению водородом при обычных условиях
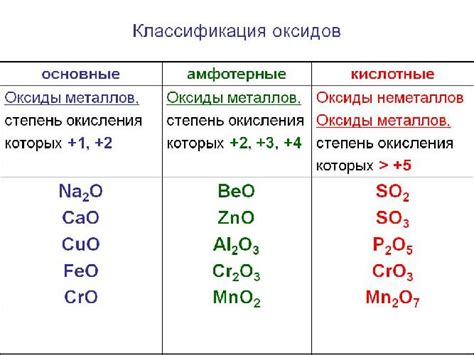
В химии существует ряд оксидов, которые не могут быть восстановлены водородом до свободного металла при стандартных условиях. Это связано с их высокой энергией окисления и стабильностью соединений.
Одним из таких оксидов является оксид алюминия (Al2O3), известный также как алюминиевый оксид или кишечный краситель. Он обладает кристаллической структурой и встречается в виде минерала боксита. Оксид алюминия широко используется в промышленности, например, в производстве стекла и керамики.
Другим примером такого оксида является оксид кремния (SiO2), известный как кварц. Он является одним из самых распространенных минералов на Земле и обладает высокой твердостью и химической стабильностью. Кварц используется в различных отраслях промышленности, включая электронику, стекло и керамику.
Также следует упомянуть оксид свинца (PbO), который также невосстанавливаем водородом до свободного металла при обычных условиях. Он имеет желтый цвет и используется в производстве стекла, керамики и пигментов.
В целом, оксиды, не поддающиеся восстановлению водородом при обычных условиях, обладают высокой стабильностью и химической инертностью, что делает их ценными материалами в промышленности и других областях применения.
Вопрос-ответ
Какие оксиды не могут быть восстановлены водородом до свободного металла?
Оксиды не могут быть восстановлены водородом до свободного металла, если восстановление является энергетически невыгодным или если оксид обладает высокой степенью стабильности.
Почему некоторые оксиды не могут быть восстановлены водородом до свободного металла?
Оксиды, которые не могут быть восстановлены водородом до свободного металла, обычно обладают высокой энергетической устойчивостью. Это связано с различными факторами, включая энергию связи между атомами в оксиде и энергию образования газа водорода.
Какие факторы определяют невозможность восстановления некоторых оксидов водородом до свободного металла?
Невозможность восстановления некоторых оксидов водородом до свободного металла определяется энергией связей в оксиде, энергией образования газа водорода, а также энергетической выгодностью процесса восстановления.
Какие металлы образуют оксиды, не поддающиеся восстановлению водородом до свободной формы?
Некоторые металлы, такие как магний, алюминий и кремний, образуют оксиды, которые не могут быть восстановлены водородом до свободного металла при стандартных условиях.
Можно ли восстановить оксиды водородом до свободного металла при повышенной температуре?
В некоторых случаях оксиды могут быть восстановлены водородом до свободного металла при повышенной температуре. Однако, некоторые оксиды все равно остаются стабильными и не могут быть восстановлены даже при повышенной температуре.
Какие свойства оксидов делают их невосстанавливаемыми водородом?
Оксиды, которые не могут быть восстановлены водородом до свободного металла, обычно имеют высокую энергию связи между атомами в оксиде и энергию образования газа водорода, что делает восстановление энергетически невыгодным.
