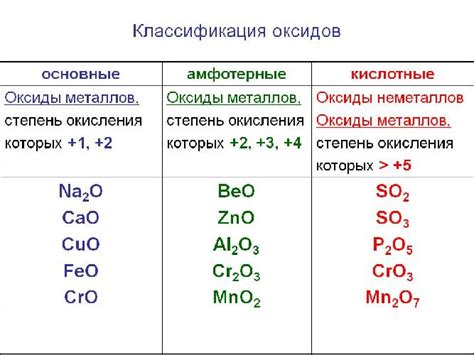
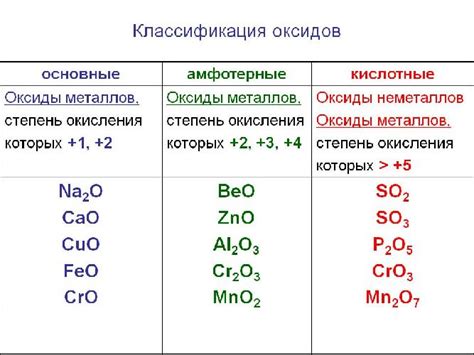
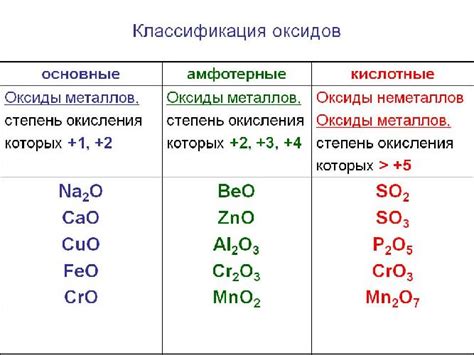
Кислотные оксиды представляют собой соединения металлов с кислородом, обладающие кислотными свойствами. Эти соединения образуются в результате реакции металла с кислородом при высоких температурах или взаимодействии металла с кислородсодержащими соединениями. Они обычно имеют формулу MO, где M - металл, а O - кислород.
Многие металлы образуют кислотные оксиды, включая алюминий, железо, цинк, медь, свинец и другие. Кислотные оксиды важны как промышленные сырье, так и в химических процессах. Они могут использоваться в производстве стекла, керамики, красок и других материалов.
Кислотные оксиды обладают кислотными свойствами: они реагируют с щелочами, образуя соли, и с водой, образуя кислоты. Кроме того, они могут быть использованы как окислители в различных химических реакциях.
Интересно отметить, что некоторые металлы могут образовывать несколько типов оксидов, таких как гидроксиды, основные оксиды и кислотные оксиды. Например, железо образует как оксид железа(II) FeO (основной оксид), так и оксид железа(III) Fe2O3 (кислотный оксид).
Образование кислотных оксидов металлами
Кислотные оксиды – это соединения, образуемые некоторыми металлами в реакции с кислородом. При этом металлы могут приобретать положительные заряды и становиться ионами, что позволяет им реагировать с кислородом и образовывать оксиды.
Металлы, способные образовывать кислотные оксиды, включают алюминий, железо, медь, цинк, свинец и некоторые другие. При взаимодействии этих металлов с кислородом происходит окисление металла, а кислород – его восстановление. В результате образуется оксид металла, который обладает кислотными свойствами.
Например, алюминий при сгорании образует оксид Al2O3, который является кислотным. Железо взаимодействует с кислородом и образует оксид Fe2O3, также обладающий кислотными свойствами.
Кислотные оксиды обладают способностью реагировать с водой, образуя кислоты. Такие реакции могут происходить с образованием дополнительных соединений, например, оснований.
Образование кислотных оксидов металлами – это важный процесс, который имеет множество применений. Кислотные оксиды используются в производстве различных химических соединений, включая керамику, стекло и многие другие материалы.
Металлы, образующие кислотные оксиды
Кислотные оксиды – это оксиды, которые образуются при соединении металлов с кислородом. Эти оксиды способны образовывать кислоты при контакте с водой. Возможность образования кислоты является следствием того, что металл в кислотном оксиде обладает высокой электроотрицательностью.
Одним из примеров металлов, образующих кислотные оксиды, является алюминий (Al). При соединении алюминия с кислородом образуется оксид алюминия (Al2O3), который известен как алюминиевая кислота. Он обладает кислотными свойствами при реакции с водой.
Еще одним металлом, образующим кислотные оксиды, является железо (Fe). Оксид железа (Fe2O3), также известный как ржавчина, образует кислоту при контакте с водой.
Некоторые другие металлы, образующие кислотные оксиды, включают цинк (Zn), магний (Mg), медь (Cu), свинец (Pb) и титан (Ti).
Итак, металлы, образующие кислотные оксиды, обладают способностью образовывать кислоты при контакте с водой. Алюминий, железо и другие металлы имеют высокую электроотрицательность, что позволяет им образовывать кислотные оксиды, обладающие кислотными свойствами.
Как металлы образуют кислотные оксиды?

Металлы могут образовывать кислотные оксиды благодаря своим химическим свойствам. Кислотный оксид - это соединение металла с кислородом, которое обычно обладает кислотными свойствами и растворяется в воде, образуя кислоту.
Когда металл вступает в реакцию с кислородом, его атомы отдают электроны, образуя положительно заряженные ионы. При этом кислород принимает эти электроны, становясь отрицательно заряженным ионом. Такое перенос электронов приводит к образованию ионной связи, что дает возможность образованию кислотного оксида.
Металлы образуют различные кислотные оксиды в зависимости от их валентности и положения в периодической системе. Некоторые примеры металлических кислотных оксидов включают оксиды алюминия (Al2O3), железа (Fe2O3), титана (TiO2) и цинка (ZnO).
Кислотные оксиды металлов играют важную роль в химических реакциях и различных промышленных процессах. Они могут использоваться в производстве кислот, стекла, эмалей и других материалов. Кроме того, некоторые кислотные оксиды металлов имеют фармацевтическое и медицинское применение.
В целом, образование кислотных оксидов металлов является важным аспектом химии и позволяет металлам выполнять различные функции и служить основой для создания различных материалов и соединений.
Металлы, которые образуют только один кислотный оксид
Существуют металлы, которые образуют только один кислотный оксид. Это значит, что при взаимодействии с кислородом металл образует только одну разновидность оксида.
Один из таких металлов - медь. При взаимодействии меди с кислородом образуется только один кислотный оксид - оксид меди (I). Оксид меди (I) обычно имеет желтовато-красный цвет и используется, например, в стекле для придания ему красного оттенка.
Еще одним примером металла, образующего только один кислотный оксид, является серебро. При взаимодействии серебра с кислородом образуется оксид серебра (I), который имеет темно-серый цвет и широко применяется для производства фоточувствительных материалов.
Алюминий также относится к металлам, образующим только один кислотный оксид. При взаимодействии алюминия с кислородом образуется оксид алюминия (III), который имеет белый цвет и часто применяется в производстве керамики и стекла.
Это лишь некоторые примеры металлов, образующих только один кислотный оксид. Каждый из них имеет свои особенности и применение в различных отраслях промышленности.
Металлы, образующие различные кислотные оксиды
Существует большое количество различных металлов, образующих кислотные оксиды при взаимодействии с кислородом. Кислотные оксиды являются соединениями, содержащими кислород и металл, и обладающими кислотными свойствами.
Одним из наиболее известных металлов, образующих кислотные оксиды, является алюминий. При взаимодействии с кислородом алюминий образует оксид алюминия (Al2O3), который применяется в производстве керамики, стекла и электролитического алюминия.
Железо - еще один металл, образующий кислотные оксиды. При взаимодействии с кислородом железо образует оксиды, такие как FeO, Fe2O3 и Fe3O4. Эти оксиды широко применяются в производстве стали и других металлургических процессах.
Еще одним примером металла, образующего кислотные оксиды, является медь. При взаимодействии с кислородом медь образует оксид меди (CuO), который применяется в различных областях, включая производство электроники и керамики.
В целом, существует большое множество металлов, образующих кислотные оксиды. Каждый из них имеет свои особенности и применение в различных сферах человеческой деятельности.
Функции кислотных оксидов в химии
Кислотные оксиды – это соединения, которые обладают кислотными свойствами и образуются в результате соединения металлов с кислородом. Они играют важную роль в химии и имеют различные функции.
Первая функция кислотных оксидов – это их участие в процессе образования кислот. Когда кислотный оксид взаимодействует с водой, образуется кислота. Например, оксид серы SO2 реагирует с водой и образует серную кислоту H2SO3. Это важный процесс, который позволяет получать различные кислоты для использования в разных отраслях промышленности.
Вторая функция кислотных оксидов связана с их способностью быть отличными окислителями. Окисление – это процесс передачи электронов от одного вещества к другому. В данном случае, кислотный оксид передаёт электроны окислимому веществу. Это позволяет использовать кислотные оксиды в химических реакциях с экзотермическими реагентами, такими как металлы или органические вещества.
Третья функция кислотных оксидов – это их использование в качестве катализаторов. Катализаторы – это вещества, которые ускоряют химическую реакцию, но самостоятельно не участвуют в ней. Кислотные оксиды могут выступать в роли катализаторов в различных процессах, таких как окисление органических соединений или синтез аммиака.
Кислотные оксиды имеют ещё множество других функций и применений. Например, они используются в производстве стекла, консервантах пищи, лекарственных препаратах и многих других областях науки и техники. Изучение функций кислотных оксидов является важной задачей химии и способствует развитию различных промышленных процессов и технологий.
Как использовать кислотные оксиды в промышленности
Кислотные оксиды – это вещества, которые образуются при сжигании металлов в присутствии кислорода. Они обладают выраженными кислотными свойствами и широко используются в различных отраслях промышленности.
Одним из основных способов использования кислотных оксидов является их применение в производстве химических соединений. С помощью оксидов металлов, таких как сера, азот и серебро, производятся различные кислоты, соли и комплексные соединения. Эти вещества широко используются в производстве пластмасс, удобрений, лекарственных препаратов и других химических продуктов.
Кислотные оксиды также активно применяются в металлургической промышленности. Они используются для очистки и обработки металлов, таких как алюминий, железо и медь. Оксиды этих металлов обладают сильными окислительными свойствами и способны выделять кислород из других веществ, что позволяет очищать и улучшать качество металлических изделий.
Кроме того, кислотные оксиды находят применение в электронной промышленности. Например, оксиды таких металлов, как кремний и олово, используются для создания полупроводниковых материалов. Они обладают особыми электрическими свойствами и позволяют создавать высокоэффективные и компактные электронные компоненты.
В заключение можно сказать, что кислотные оксиды играют важную роль в промышленности. Они находят широкое применение в производстве химических соединений, металлургии и электронике. Благодаря своим уникальным свойствам, они позволяют создавать новые материалы, улучшать качество продукции и повышать эффективность производства.
Примеры сплавов на основе кислотных оксидов
Кислотные оксиды - это химические соединения, представляющие собой оксиды неметаллов, которые образуют кислоты при растворении в воде. Они часто используются в процессе изготовления сплавов, которые обладают различными свойствами и широким спектром применений.
Примером сплава, содержащего кислотные оксиды, является лава - это смесь твёрдых и вяжущих материалов, которые при нагревании растворяются и образуют текучую массу. Данный сплав, содержащий оксиды кремния, алюминия и кальция, используется в производстве различных строительных материалов, таких как керамические плитки, кирпичи и огнеупорные изделия.
Еще одним примером является нержавеющая сталь, которая содержит оксиды хрома и никеля. Этот сплав обладает высокой стойкостью к коррозии и широко применяется в производстве кухонных принадлежностей, медицинского оборудования, автомобильных деталей и других изделий, где необходима высокая прочность при работе в агрессивных средах.
Важным примером является также алюминиевый сплав, содержащий оксид алюминия. Этот сплав обладает низкой плотностью, хорошей прочностью и устойчивостью к коррозии. Из него изготавливаются легкие конструкции, такие как самолеты, автомобили, спортивные снаряды, а также различные электронные устройства.
Опасность использования кислотных оксидов в быту
Кислотные оксиды, такие как диоксид серы, диоксид углерода и диоксид азота, могут представлять опасность при использовании в быту. Эти вещества могут быть образованы в результате сгорания или разложения различных материалов, таких как горючие газы или топлива в автомобильных двигателях.
Одним из основных опасностей, связанных с использованием кислотных оксидов, является их ядовитое действие на организм человека. Вдыхание высоких концентраций этих веществ может вызывать различные заболевания легких, такие как бронхит и астма. Кроме того, кислотные оксиды могут вызывать раздражение глаз и кожи, при контакте с ними.
Другой опасностью использования кислотных оксидов является их влияние на окружающую среду. Они способны вызывать кислотные дожди, что может привести к загрязнению водоемов и почвы. Кислотные оксиды также являются важными факторами при формировании городского смога, что негативно сказывается на здоровье населения.
На основе вышесказанного, можно сделать вывод о необходимости предоставления достоверной информации о рисках использования кислотных оксидов в быту и необходимости применения соответствующих мер безопасности. Кроме того, важно развивать и использовать альтернативные технологии и материалы, которые не образуют кислотные оксиды или образуют их в незначительных количествах, чтобы минимизировать негативное влияние на здоровье человека и окружающую среду.
Вопрос-ответ
Какие металлы образуют кислотные оксиды?
Многие металлы образуют кислотные оксиды. Некоторые из них включают алюминий, железо, медь, цинк, свинец и многие другие.
Какие металлы образуют кислотные оксиды и для чего они используются?
Различные металлы образуют кислотные оксиды, такие как алюминиевый оксид, железный оксид и медный оксид, которые имеют различные применения. Алюминиевый оксид используется, например, в производстве керамики и синтетических кристаллов. Железный оксид часто применяется для окрашивания и антикоррозионной защиты различных поверхностей, а медный оксид используется в производстве электронных компонентов, таких как интегральные схемы и солнечные батареи.
Которые металлы образуют кислотные оксиды и какие свойства у этих оксидов?
Некоторые металлы, такие как алюминий, железо и медь, образуют кислотные оксиды. Кислотные оксиды обладают кислотными свойствами, то есть они могут реагировать с водой и образовывать кислоты. Они также могут быть еще более активными и реагировать с основаниями, образуя соли. Например, железный оксид (Fe2O3) образует кислоту при реакции с водой и может реагировать с основанием, образуя соль.
Какие металлы образуют кислотные оксиды и как они получаются?
Металлы, такие как алюминий, железо, медь, цинк и другие, могут образовывать кислотные оксиды. Кислотные оксиды образуются в результате соединения металлического элемента с кислородом. Например, железный оксид (Fe2O3) образуется при реакции железа с кислородом. Оксид образуется во время окисления металла, когда он взаимодействует с кислородом в воздухе или веществе.
