Взаимодействие металла с электролитом является важным физико-химическим процессом, который происходит во многих областях промышленности и научных исследований. Этот процесс имеет большую роль в электрохимической коррозии, гальванических элементах, электролизе и других процессах, связанных с преобразованием энергии. В данной статье мы рассмотрим основные процессы взаимодействия металла с электролитом.
Один из основных процессов, связанных с взаимодействием металла с электролитом, - это коррозия. Коррозия - это процесс разрушения металла в результате его взаимодействия с окружающей средой. Она может происходить как в атмосфере, так и в водных средах, в зависимости от условий эксплуатации металла. Коррозия является одной из основных причин разрушения металлических конструкций и технических устройств.
Взаимодействие металла с электролитом также может происходить в гальванических элементах, таких как аккумуляторы или батареи. В гальванических элементах металлы вступают в реакцию с электролитом, что позволяет преобразовать химическую энергию в электрическую энергию. Этот процесс основан на разности потенциалов между разными металлами и их способности образовывать ионные соединения.
Кроме того, взаимодействие металла с электролитом может происходить при электролизе. Электролиз - это процесс, при котором путем пропускания постоянного электрического тока через электролит происходит разложение вещества на ионы. При электролизе металлы могут выделяться на электроде или растворяться в электролите в зависимости от их электрохимических свойств.
Процессы химического взаимодействия металла с электролитом
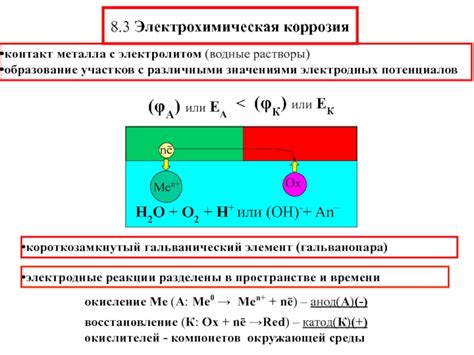
Химическое взаимодействие металла с электролитом основано на электрохимических процессах, которые происходят на границе раздела металл-раствор. Одним из основных процессов является окисление металла, при котором его атомы или ионы переходят в более высокоокисленное состояние.
При окислении металл отдает электроны, которые перемещаются внутри металла и через внешнюю цепь к аноду, образуя электрический ток. Сам металл после окисления превращается в ионы, которые переходят в раствор электролита.
В электролите ионы металла, полученные в результате окисления, могут претерпевать различные процессы. Одни ионы могут образовывать нерастворимые соединения с другими ионами электролита, что приводит к образованию осадков. Другие ионы могут образовывать растворимые соединения или просто находиться в растворе в виде одиночных ионов.
В результате процессов химического взаимодействия металла с электролитом могут образовываться различные продукты, такие как осадки, растворы и газы. Эти продукты могут иметь как положительные, так и отрицательные эффекты. С одной стороны, формирование защитной пленки на поверхности металла может предотвратить его дальнейшее окисление и коррозию. С другой стороны, образование осадков или нерастворимых соединений может привести к образованию отложений и забиванию системы.
Таким образом, процессы химического взаимодействия металла с электролитом играют важную роль в многих областях, таких как электрохимия, коррозия и металлургия. Понимание этих процессов позволяет разрабатывать эффективные методы защиты металлов от коррозии и обеспечивать надежную работу технических систем, основанных на использовании металлических материалов.
Электролиз и электрохимическая коррозия
Электролиз – это процесс, при котором электрический ток приводит к химическим изменениям вещества. Он основан на электрохимической реакции, которая происходит между электролитом и электродами. В процессе электролиза вещество (электролит) разлагается на положительные и отрицательные ионы под действием электрического тока. При этом на катоде происходит восстановление вещества, а на аноде происходит окисление. Электролиз может проводиться как водных растворах, так и в расплавах.
Электрохимическая коррозия – это процесс, при котором металл под действием электролита претерпевает химическое разрушение. При электрохимической коррозии происходит окисление металла, при этом сам металл служит анодом, а окружающая его среда – катодом. Электролитическое воздействие приводит к образованию оксидов или солей металла, что приводит к потере веса и разрушению металла. Электрохимическая коррозия является одной из основных причин разрушения металлических конструкций и изделий.
Коррозия металла под воздействием электролита может быть усиленная или уменьшенная в зависимости от ряда факторов, таких как состав электролита, температура, избыток кислорода и другие. Для защиты металла от электрохимической коррозии применяют различные методы, такие как покрытие металла защитным слоем, использование анодной защиты или применение ингибиторов коррозии.
Итак, электролиз и электрохимическая коррозия являются взаимосвязанными процессами, которые возникают при взаимодействии металла с электролитом. Понимание и контроль этих процессов позволяют улучшить защиту металла от коррозии и повысить эффективность использования металлических изделий в различных отраслях промышленности.
Пассивация и анодающие процессы
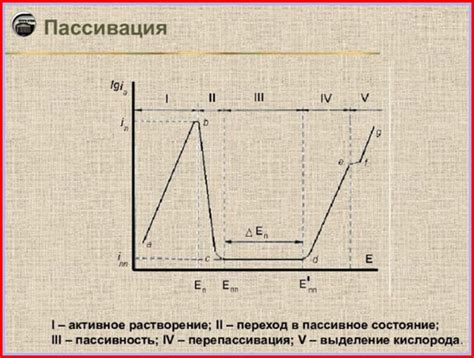
Пассивация – это явление, при котором металл, находящийся в контакте с электролитом, образует на своей поверхности защитную пассивную пленку. Эта пленка состоит из оксидов, гидроксидов или солей металла и обладает высокой устойчивостью к дальнейшему взаимодействию с электролитом.
Пассивация происходит благодаря механизму оксидации металла при взаимодействии с кислородом или другими химическими веществами, присутствующими в электролите. Образовавшаяся пленка позволяет защитить металл от дальнейшей коррозии, предотвращая проникновение агрессивных веществ внутрь металлической структуры.
Анодающие процессы являются противоположными пассивации. Они возникают при подаче напряжения на металлический объект. При этом электролит начинает входить в реакцию с поверхностью металла, вызывая электрохимическую коррозию. Такие процессы обычно возникают при гальванической коррозии, когда металлы различной электрической проводимости находятся в контакте между собой и взаимодействуют через электролит.
Диффузия и ионная миграция
Диффузия и ионная миграция - это два основных процесса взаимодействия металла с электролитом. Диффузия представляет собой процесс распространения атомов или молекул металла в электролите. В результате диффузии, атомы металла могут перемещаться от области с более высокой концентрацией к области с более низкой концентрацией. Этот процесс играет важную роль в различных технологических процессах, таких как закалка стали или диффузия примесей в полупроводниковых материалах.
Ионная миграция является активным перемещением ионов металла в электролите под воздействием электрического поля. Как известно, металлы могут образовывать ионы с положительным зарядом. Под действием электрического поля, положительные ионы могут направляться к отрицательному электроду, а отрицательные ионы - к положительному электроду. Это явление широко используется в электролизе, где ионная миграция играет ключевую роль в процессах осаждения металла на электроде.
Диффузия и ионная миграция взаимосвязаны и могут влиять друг на друга. Например, при проведении электролиза с буксыровкой металла на электрод, диффузия может способствовать перемещению металла к поверхности электрода, а ионная миграция - активному перемещению ионов вокруг электрода. Эти процессы могут влиять на качество и равномерность покрытия на поверхности металла.
Окисление и восстановление металла
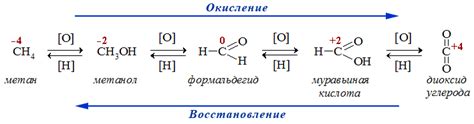
Окисление и восстановление металла являются основными процессами его взаимодействия с электролитом. Окисление – это процесс, при котором металл отдает электроны и превращается в ион положительного заряда. Восстановление – это обратный процесс, при котором металл принимает электроны и возвращается в исходное состояние.
В окислительно-восстановительных реакциях, происходящих между металлом и электролитом, основную роль играют электрохимические реакции. Когда металл окисляется, его атомы превращаются в положительно заряженные ионы, образуя соли металла, которые растворяются в электролите.
Восстановление металла происходит благодаря передаче электронов от электролита на поверхность металла. Электролит, в свою очередь, может быть окислителем и принимать электроны или же служить нейтральным участником реакции.
Окисление и восстановление металла широко используются в различных процессах, таких как электрохимическая обработка, гальваническое покрытие и производство электроэнергии. Эти процессы основаны на способности металла окисляться и восстанавливаться под воздействием электрического тока.
Понимание процессов окисления и восстановления металла позволяет контролировать и управлять его поведением в различных условиях. Это важно для обеспечения устойчивости и эффективности металлических конструкций и изделий в различных отраслях промышленности.
Реакции гидролиза и образование оксидов
Реакции гидролиза являются одним из основных процессов взаимодействия металлов с электролитами. В результате гидролиза металлический ион образует гидроксид, а электроотрицательный ион электролита образует кислоту или основание.
Образование оксидов в результате взаимодействия металла с электролитом также является значимым процессом. При данной реакции металлический ион соединяется с кислородом, образуя оксид металла.
Гидролиз и образование оксидов являются взаимосвязанными процессами. Например, в результате гидролиза катионы металлов в растворе связываются с гидроксидными и гидроксоионами, образуя гидроксиды металлов. При дальнейшем взаимодействии этих гидроксидов с кислородом возникает образование оксидов металлов.
Образование оксидов имеет большое значение как в химической промышленности, так и в природных процессах. Например, окисление железа при взаимодействии с кислородом влекло за собой образование ржавчины. Важно отметить, что оксиды металлов являются активными катализаторами многих химических реакций.
Образование пленки и строение оксидных оболочек
Образование пленки и строение оксидных оболочек на поверхности металла является важным процессом во взаимодействии металла с электролитом. Оксидные оболочки, такие как оксид железа, алюминия и цинка, образуются на поверхности металла в результате окисления металлической поверхности.
Структура оксидных оболочек может быть различной в зависимости от условий образования и типа металла. Например, оксиды алюминия образуют плотные и прочные пленки, которые эффективно защищают алюминий от дальнейшей коррозии. Оксиды железа, напротив, могут иметь пористую структуру, что приводит к дальнейшему проникновению влаги и кислорода и усиливает процесс коррозии.
Плотность и структура оксидной пленки могут также зависеть от состава электролита и условий обработки. Например, добавление определенных добавок в электролит может привести к образованию более плотной и прочной пленки, что повышает стойкость металла к коррозии.
Оксидные оболочки на поверхности металла также могут выполнять защитную роль, предотвращая проникновение вредных веществ в металлическую структуру. Однако в некоторых случаях оксидные оболочки могут быть дефектными или пористыми, что приводит к усилению процесса коррозии и растрескиванию металла.
Вопрос-ответ
Что такое электролит?
Электролит - это вещество, способное проводить электрический ток и разлагаться на ионы в растворе.
Как происходит взаимодействие металла с электролитом?
Взаимодействие металла с электролитом происходит через процессы окисления и восстановления, а также за счет электролитической диссоциации.
Какие основные процессы происходят при взаимодействии металла с электролитом?
Основные процессы при взаимодействии металла с электролитом - это анодный и катодный процессы. В анодном процессе металл окисляется и отдает электроны, а в катодном процессе он восстанавливается.
Какие факторы влияют на скорость взаимодействия металла с электролитом?
На скорость взаимодействия металла с электролитом влияют такие факторы, как температура, концентрация электролита, поверхностная площадь металла, рН среды и наличие катализаторов.
Что происходит с металлом при взаимодействии с электролитом?
При взаимодействии металла с электролитом на его поверхности образуется окисная пленка, которая может быть защитной или пористой. В результате взаимодействия металла с электролитом может происходить его коррозия или электролиз.
Какие свойства электролита могут влиять на взаимодействие с металлом?
Свойства электролита, которые могут влиять на взаимодействие с металлом, включают его концентрацию, основные и кислотные свойства, органические добавки и наличие примесей.
