Электрохимический эквивалент металла - это физическая величина, которая позволяет определить количество вещества, участвующего в электрохимической реакции. Он показывает, сколько граммов металла окисляется или восстанавливается на 1 кулон электричества. Расчет электрохимического эквивалента металла может быть полезен в различных областях, включая аналитическую химию, электрохимический анализ и гальванические работы.
Существует несколько способов рассчитать электрохимический эквивалент металла. Один из них основан на измерении массы металла, которая ощущается или выделяется в результате электрохимической реакции. Для этого необходимо провести экспериментальные измерения, записать значения электротока и длительности реакции, а затем использовать формулу, которая связывает эти величины.
Второй способ основан на использовании стандартного электродного потенциала металла. Известно, что разница потенциалов между электродом и стандартным электродом водорода связана с разницей в их электрохимических эквивалентах. При известном стандартном электродном потенциале металла и водорода можно рассчитать электрохимический эквивалент металла с использованием уравнения Нернста и других электрохимических данных.
Что такое электрохимический эквивалент металла и как его рассчитать
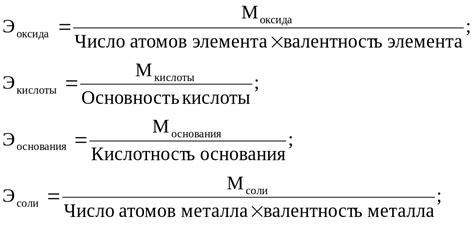
Электрохимический эквивалент металла - это количество вещества металла, осаждаемого или растворяющегося во время электрохимической реакции, при прохождении одного кулонa электричества через электролит с раствором данного металла.
Расчет электрохимического эквивалента металла выполняется по формуле:
эквивалент = масса / (заряд * число электронов)
Где масса - это масса растворимого или осаждаемого вещества, заряд - заряд ионов, включающихся в реакцию, а число электронов - количество перенесенных электронов при прохождении одного кулона заряда.
Расчет электрохимического эквивалента металла позволяет определить количество вещества, которое будет осаждаться или растворяться в процессе электрохимической реакции. Это важно для проведения различных электрохимических исследований, а также для проектирования и оптимизации электрохимических процессов.
Что такое электрохимический эквивалент
Электрохимический эквивалент представляет собой величину, которая показывает, сколько вещества осаждается или растворяется при прохождении определенного количества электричества через электролитическую ячейку. Измеряется он в граммах на кулон.
Электрохимический эквивалент позволяет установить пропорциональную связь между полученным количеством вещества и переданным зарядом. Он зависит как от величины заряда, так и от химической реакции, которая происходит в электролитической ячейке.
Рассчитать электрохимический эквивалент можно по формуле: электрохимический эквивалент = масса вещества / заряд. Для этого необходимо знать массу вещества, полученную или растворенную при прохождении известного количества электричества через электролитическую ячейку.
Электрохимический эквивалент является важным показателем при проведении различных электрохимических процессов, таких как электролиз, гальваническая коррозия и другие. Он помогает оценить количество вещества, которое может быть получено или растворено при определенных условиях электролитической ячейки.
Методы расчета электрохимического эквивалента

Электрохимический эквивалент металла представляет собой количество электричества, проходящего через растворение 1 грамма металла в электролите. Его рассчитывают на основе экспериментальных данных, полученных при проведении электролиза металлического образца.
Один из методов рассчета электрохимического эквивалента основан на измерении массы металла, осажденного на катоде в результате электролиза. Для этого необходимо знать время, в течение которого происходит осаждение металла, и силу тока, протекающего через электролит. Измерив массу металла и зная количество электричества, перешедшего через раствор, можно вычислить электрохимический эквивалент.
Другой метод основан на измерении количества металла, растворенного в химическом процессе. Для этого используют методику вихревого «микроэлектролиза», когда на маленьком образце металла, помещенном в электролит, применяются короткие импульсы тока. По количеству металла, перешедшего в раствор, можно определить электрохимический эквивалент.
Третий метод основан на измерении теплового эффекта электрохимического процесса. С помощью калориметра измеряют изменение температуры, происходящее в результате реакции. Используя уравнение Гиббса, можно рассчитать количество электричества, перешедшего через раствор, и, следовательно, электрохимический эквивалент металла.
Применение электрохимического эквивалента металла
Электрохимический эквивалент металла, который представляет собой количество вещества, соответствующее передвижению одного кулона заряда через электролитическую ячейку, имеет широкое применение в различных областях науки и промышленности.
Один из основных способов использования электрохимического эквивалента металла – определение его массы при проведении электрохимических реакций. Зная эквивалент металла, можно расчитать массу вещества, осажденного или растворенного в реакции.
Электрохимический эквивалент металла является важной характеристикой материала и используется при проектировании и производстве электрохимических устройств, таких как аккумуляторы и гальванические элементы. Расчеты с использованием эквивалента металла помогают определить энергетические и электрохимические свойства устройства и прогнозировать его работу.
Также эквивалент металла может быть использован для управления и контроля электролитических процессов в производстве металлов, например, в гальваническом покрытии. Зная эквивалент металла, можно определить время и энергию необходимые для проведения процесса покрытия и контролировать его качество.
Кроме того, с использованием электрохимического эквивалента металла возможно определить электрохимические параметры, такие как электрическая емкость, сопротивление и концентрация ионов в растворе. Это позволяет анализировать и улучшать работу электрохимических устройств и процессов.
Вопрос-ответ
Как рассчитать электрохимический эквивалент металла?
Электрохимический эквивалент металла можно рассчитать с помощью формулы: электрохимический эквивалент = масса металла / количество электричества, переданного во время электролиза. Также можно использовать данные из таблицы стандартных потенциалов для нахождения эквивалента.
Какая формула используется для расчета электрохимического эквивалента металла?
Формула для расчета электрохимического эквивалента металла выглядит следующим образом: электрохимический эквивалент = масса металла / количество электричества, переданного во время электролиза.
Какие данные нужны для расчета электрохимического эквивалента металла?
Для расчета электрохимического эквивалента металла необходимо знать массу металла и количество электричества, переданного во время электролиза. Также можно использовать данные из таблицы стандартных потенциалов.
Можно ли использовать таблицу стандартных потенциалов для расчета электрохимического эквивалента металла?
Да, можно использовать данные из таблицы стандартных потенциалов для расчета электрохимического эквивалента металла. По значениям стандартных потенциалов можно определить, сколько электричества было передано при электролизе, и соответствующим образом рассчитать эквивалент.
Какие единицы измерения используются для электрохимического эквивалента металла?
Электрохимический эквивалент металла обычно измеряется в г/Кл или г/А*ч - граммах на кулон или граммах на ампер-час. Величина эквивалента зависит от конкретного металла и условий эксперимента.
Какие факторы могут влиять на электрохимический эквивалент металла?
Несколько факторов могут влиять на электрохимический эквивалент металла. Важными факторами являются условия эксперимента, такие как концентрации растворов, температура, давление и прочие факторы, а также состояние поверхности металла и наличие примесей.

