Взаимодействие металлов с хлором является одной из важных химических реакций в нашей жизни. Хлор является одним из самых распространенных элементов в природе и обладает высокой реакционной активностью. Взаимодействие металла с хлором может протекать различными способами в зависимости от условий, в которых оно происходит.
Одним из основных способов взаимодействия металла с хлором является образование хлоридов. Хлориды металлов обладают высокой стабильностью и широко используются в различных отраслях промышленности. В процессе реакции металл уступает свои электроны хлору и образует положительно заряженные ионы. Эти ионы вместе с отрицательно заряженными ионами хлора образуют кристаллическую решетку хлорида металла.
Взаимодействие металла с хлором может протекать и в других формах. Например, взаимодействие алюминия с хлором может привести к образованию солей алюминия и образованию газа хлороводорода. Использование этой реакции нашло применение в различных областях, таких как промышленность и медицина.
Взаимодействие металла с хлором: особенности и реакция

Взаимодействие металлов с хлором представляет собой процесс химической реакции между металлическим элементом и хлором. Под воздействием хлора происходит окисление металла, что приводит к образованию металличеслого хлорида. Такие реакции обладают рядом особенностей и имеют важное применение в различных сферах науки и промышленности.
При взаимодействии металлов с хлором образуется металлический хлорид, который может иметь различное строение и свойства. Например, в случае взаимодействия железа с хлором образуется железо(III) хлорид (FeCl3), который обладает ярко выраженным красным цветом. При этом может происходить выделение тепла и образование хлороводорода, что делает реакцию металла с хлором заметной и энергичной.
Взаимодействие металла с хлором может быть использовано для получения различных продуктов. Например, в промышленном масштабе реакция алюминия с хлором используется для получения алюминия в чистом виде. Алюминий образует стабильное соединение с хлором - алюминийхлорид (AlCl3), которое затем может быть подвергнуто электролизу для получения чистого алюминия.
Однако взаимодействие металла с хлором может быть опасным процессом из-за выделения хлороводорода и высокой реактивности хлора. Поэтому при проведении таких реакций необходимо соблюдать особые меры безопасности и работать в специально оборудованных помещениях.
Важность понимания реакции
Понимание реакции между металлом и хлором является важным для различных областей, таких как химическая и металлургическая промышленность, а также для научных исследований. Реакция металла с хлором может приводить к образованию различных веществ и иметь важные последствия.
Одной из особенностей взаимодействия металла с хлором является образование солей металла, которые могут иметь различное применение. Например, хлорид натрия (NaCl) широко используется в пищевой и химической промышленности, а хлорид железа (FeCl3) применяется в процессах обработки воды и производства красителей.
Понимание реакции металла с хлором также имеет важное значение для безопасности. Неконтролируемая реакция металла с хлором может привести к образованию опасных веществ, таких как газ хлороводород (HCl). Данный газ очень вреден при вдыхании и может вызывать серьезные ожоги или отравление.
Более того, предварительное понимание реакции металла с хлором позволяет определить наиболее эффективные методы использования этого взаимодействия в различных процессах. Например, в металлургической промышленности реакция между металлом и хлором может использоваться для очистки металлов от примесей или для получения специфических соединений.
Таким образом, понимание реакции металла с хлором имеет огромное значение для различных областей исследований и промышленности, способствуя развитию новых материалов, методов очистки и производства, а также обеспечивая безопасность в процессе обращения с хлором и металлами.
Вещества, участвующие в реакции

Реакция между металлом и хлором является побочной реакцией, образующаяся при взаимодействии активного металла с галогеном. Веществами, участвующими в этой реакции, являются металлы и хлор.
Металлы, обладающие высокой активностью, такие как натрий, калий, магний и алюминий, могут реагировать с хлором. При этом происходит окислительно-восстановительная реакция, в результате которой металл окисляется, а хлор восстанавливается.
Взаимодействие металла с хлором приводит к образованию соли. Например, реакция натрия с хлором приводит к образованию хлорида натрия (NaCl), калия с хлором - к образованию хлорида калия (KCl), а магния с хлором - к образованию хлорида магния (MgCl2).
Вещество, полученное в результате реакции металла с хлором, обладает характерными свойствами солей. Они обычно имеют кристаллическую структуру и являются хорошими проводниками электрического тока в растворе и плохими проводниками в твердом состоянии.
Реакция между металлом и хлором может протекать с выделением тепла и света, что делает ее заметной и специфической. Также реакция может протекать с образованием высокочувствительных веществ, которые могут вызывать взрывы или пожары. Поэтому, взаимодействие металла с хлором должно происходить с осторожностью и под контролем.
Особенности химической взаимосвязи
Химическая взаимосвязь между металлом и хлором представляет собой процесс образования химической связи между атомами обоих веществ. Она основана на принципах электроотрицательности и заполнения электронных оболочек участвующих атомов.
Металлы, как правило, имеют низкую электроотрицательность и способны отдавать электроны. Хлор, напротив, обладает высокой электроотрицательностью и способен принимать электроны. В результате эти два вещества вступают в химическую реакцию, в ходе которой металл отдает один или несколько электронов хлору.
В результате такой взаимосвязи образуется ионное соединение, в котором металл представлен положительным ионом, а хлор - отрицательным ионом. Ионы такого соединения притягиваются друг к другу силой кулоновского притяжения, образуя кристаллическую решетку.
Особенностью взаимосвязи между металлом и хлором является также способность металла образовывать с хлором несколько ионов различной валентности. Это связано с возможностью металла отдавать разное количество электронов. Так, некоторые металлы способны формировать двухвалентные и трехвалентные ионы, что влияет на свойства и химическую активность получаемых соединений.
В целом, взаимодействие металла с хлором является типичным примером ионной связи, которая является основой многих важных химических процессов и играет важную роль в различных сферах промышленности и науки.
Практическое применение

Взаимодействие металла с хлором находит широкое практическое применение в различных областях науки и промышленности.
- Производство хлора: Процесс электролиза хлорида натрия (NaCl) позволяет получать чистый хлор, который широко используется в производстве пластмасс, химической промышленности и производстве промышленных моющих средств.
- Металлургия: Взаимодействие металла с хлором используют для очистки и обработки металлических поверхностей. Хлороводород, получаемый при реакции металлов с хлором, широко используется для травления металлов, удаления оксидных слоев и очистки поверхностей перед их дальнейшей обработкой.
- Производство сплавов: Реакция металла с хлором позволяет получать сплавы, которые обладают необходимыми свойствами для различных индустриальных и технических целей. Например, алюминий имеет высокую степень реакционной способности с хлором и позволяет получать алюминийхлорид, который используется при производстве лакокрасочных материалов и в качестве катализатора во многих химических реакциях.
- Очистка воды: Хлор используется для обеззараживания питьевой воды и очистки бассейнов от бактерий и вирусов. Реакция хлора с органическими загрязнениями приводит к образованию хлорорганических соединений, которые обладают антимикробными свойствами и удаляют опасные микроорганизмы.
Таким образом, взаимодействие металла с хлором находит широкое применение в различных областях промышленности и науки, обеспечивая возможность получения нужных веществ и материалов, а также очистку и обработку различных поверхностей.
Виды реакций металла с хлором
Взаимодействие металлов с хлором может проходить различными способами и вызывать различные реакции. Реакции металлов с хлором включают образование солей, газообразных продуктов и изменение окраски.
Одним из видов реакций металлов с хлором является образование хлоридов металла. При этом происходит передача электронов от металла к хлору, образуя ионы хлорида и катионы металла. Эта реакция обычно сопровождается выделением тепла и света.
Другой вид реакций металлов с хлором – образование газообразных продуктов. Некоторые металлы, например, натрий или калий, могут реагировать с хлором с выделением газа хлороводорода. В такой реакции происходит образование хлоридов металла и хлороводорода.
Также, взаимодействие металлов с хлором может приводить к изменению окраски. Например, при нагревании некоторых металлических хлоридов происходит образование комплексных соединений, которые имеют яркую окраску. Это может использоваться для идентификации некоторых металлов.
Влияние условий на скорость реакции
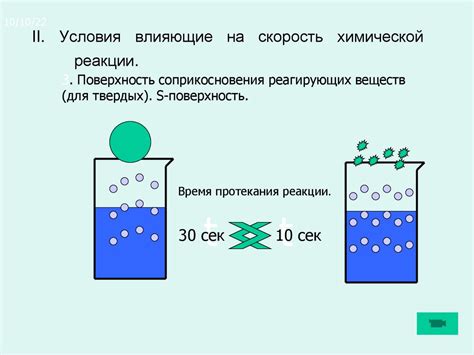
Скорость реакции между металлом и хлором зависит от нескольких факторов, которые можно изменять, чтобы ускорить или замедлить процесс. Одним из важных факторов является концентрация хлора. Чем выше концентрация хлора, тем быстрее протекает реакция, так как большое количество хлора увеличивает вероятность столкновения с металлом.
Также влияние на скорость реакции оказывает температура. При повышении температуры молекулы металла и хлора приобретают большую энергию, что способствует их активности и столкновениям. Чем выше температура, тем быстрее протекает реакция. Однако, стоит отметить, что очень высокие температуры могут привести к нежелательным побочным реакциям или распаду металла.
Размер частиц металла также оказывает влияние на скорость реакции. Более мелкие частицы металла имеют большую поверхность контакта с хлором, что увеличивает вероятность столкновения и ускоряет реакцию. Это объясняется тем, что поверхностные реакции протекают быстрее, чем объемные.
Влияние давления на скорость реакции между металлом и хлором предполагает изменение количества молекул хлора, которые могут столкнуться с металлом. Повышение давления приводит к увеличению концентрации хлора, что способствует ускорению реакции.
Сравнение реакции металла с хлором и других галогенов
Взаимодействие металла с хлором является типичным представителем реакций металлов с галогенами. Хлор является весьма активным галогеном и обладает высокой электроотрицательностью. При контакте с металлом происходит образование ионов галогена и катионов металла.
В отличие от хлора, реакция металла с другими галогенами происходит с различной интенсивностью и может иметь различные последствия. Фтор является самым активным галогеном и проявляет высокую агрессивность взаимодействия с металлами. Взаимодействие металла с фтором обычно сопровождается образованием высокостабильных фторидов и высвобождением большого количества энергии.
Более низкая активность брома и йода в сравнении с фтором и хлором означает, что реакции металла с этими галогенами протекают медленнее и обычно требуют повышенных условий, таких как повышенная температура или давление. Однако результатом таких реакций являются также стабильные соединения - бромиды и иодиды металлов.
Сравнительное изучение реакций металла с различными галогенами позволяет установить различия в их активности и способности образовывать стабильные соединения. Это знание может быть полезным для исследования свойств металлов и разработки новых материалов с желаемыми химическими и физическими свойствами.
Вопрос-ответ
Какие особенности есть во взаимодействии металла с хлором?
При взаимодействии металла с хлором происходит химическая реакция, в результате которой образуется соединение металла с хлором.
Какие реакции могут происходить при взаимодействии металла с хлором?
При взаимодействии металла с хлором могут происходить различные реакции, в зависимости от типа металла. Например, активные металлы, такие как натрий или калий, реагируют с хлором с выделением яркого пламени. Другие металлы, например, железо или алюминий, могут образовывать соединения с хлором при нагревании или при действии кислоты.
Какова химическая формула для соединения металла с хлором?
Химическая формула для соединения металла с хлором зависит от конкретного металла. Например, соединение натрия с хлором имеет формулу NaCl, соединение калия с хлором - KCl. Для разных металлов могут быть разные формулы соединений с хлором.
Какова реакция между алюминием и хлором?
Реакция между алюминием и хлором может происходить при нагревании или при действии кислоты. В результате образуется соединение алюминия с хлором, обычно его химическая формула AlCl3. Реакция между алюминием и хлором является горение, при котором выделяется тепло и образуется хлористый алюминий.
Какова реакция между железом и хлором?
Реакция между железом и хлором может происходить при нагревании или при действии кислоты. В результате образуется соединение железа с хлором, обычно его химическая формула FeCl3. Реакция между железом и хлором является окислительно-восстановительной реакцией, при которой происходит передача электронов от железа к хлору.
Какие применения может иметь взаимодействие металла с хлором?
Взаимодействие металла с хлором имеет различные применения. Например, хлор используется в процессе производства стали для удаления примесей и очистки металла. Также соединения металла с хлором могут использоваться как катализаторы в различных химических реакциях.
