Щелочные металлы – это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к самым легким металлам и характеризуются высокой реактивностью и мягкостью. Одним из интересных аспектов исследования этих металлов является их изменение плотности и точки плавления в зависимости от температуры.
Одной из особенностей щелочных металлов является то, что они обладают низкой плотностью и низкой температурой плавления. На самом деле, литий имеет самую низкую плотность среди всех известных металлов, а его точка плавления составляет всего около 180 градусов Цельсия. Однако, с увеличением атомного номера группы элементов, плотность и температура плавления щелочных металлов также увеличиваются.
Обычно, с увеличением температуры плотность щелочных металлов уменьшается. Это связано с тем, что при нагревании атомы металлов начинают двигаться быстрее и занимать больший объем. Кроме того, при достижении определенной температуры, щелочные металлы могут переходить в жидкое состояние – точка плавления. Интересно, что в некоторых случаях точка плавления щелочных металлов может быть ниже, чем у других металлических элементов с более высокой плотностью. Это явление объясняется особенностями электронной структуры и взаимодействиями атомов в решетке металла.
Изменение плотности щелочных металлов
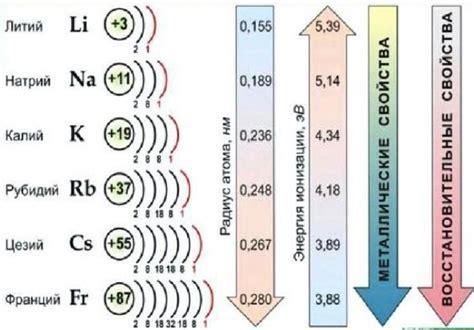
Щелочные металлы - это элементы первой группы периодической системы, которые включают литий, натрий, калий, рубидий, цезий и франций. Они отличаются низкой плотностью и низкой точкой плавления, что делает их особенно интересными для исследования.
Плотность щелочных металлов меняется в зависимости от температуры. При повышении температуры плотность обычно уменьшается. Например, у лития, которое является самым легким из щелочных металлов, плотность при повышении температуры снижается с 0,53 г/см³ при 0 °C до 0,51 г/см³ при 100 °C.
Это связано с тем, что при нагревании металлическая решетка, в которой находятся атомы металла, начинает расширяться. Расстояние между атомами становится больше, что приводит к увеличению объема металла и снижению его плотности.
Изменение плотности щелочных металлов связано также с изменением их структуры при разных температурах. Например, при комнатной температуре литий и натрий имеют кубическую решетку, а при повышении температуры они переходят в гексагональную структуру.
Таким образом, плотность щелочных металлов изменяется в зависимости от температуры, что имеет важное значение для понимания их физических свойств и применения в различных областях науки и техники.
Влияние температуры на плотность
Температура является важным параметром, влияющим на плотность щелочных металлов, таких как литий, натрий и калий. С ростом температуры плотность этих металлов изменяется, что имеет практическое значение в различных областях науки и техники.
При повышении температуры, плотность щелочных металлов обычно уменьшается. Это объясняется изменением пространственного расположения атомов в структуре металла. При низких температурах атомы щелочных металлов упорядочены в кристаллическую решетку, что приводит к большей плотности. Однако с ростом температуры атомы начинают вибрировать и перемещаться, что приводит к увеличению объема и уменьшению плотности.
Изменение плотности щелочных металлов с температурой имеет свои особенности. Например, литий имеет более высокую плотность при низких температурах, но с ростом температуры его плотность быстро уменьшается. Натрий и калий также показывают уменьшение плотности при повышении температуры, хотя у них это изменение не так существенно, как у лития.
Знание влияния температуры на плотность щелочных металлов является важным при проектировании и конструировании различных устройств и систем. Например, при разработке аккумуляторов или ядерных реакторов необходимо учитывать изменение плотности металлов при различных температурах, чтобы обеспечить надежную и эффективную работу этих систем.
Свойства щелочных металлов

1. Высокая химическая активность: щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются наиболее активными металлами в периодической системе элементов. Они легко реагируют с водой, кислородом, галогенами и другими неорганическими веществами.
2. Низкая плотность: вещества из группы щелочных металлов обладают низкой плотностью, что делает их легкими и подвижными. Например, литий имеет плотность всего 0,53 г/см³, что делает его наименьшим металлом по плотности в периодической системе.
3. Низкая температура плавления: щелочные металлы обладают низкой температурой плавления в сравнении с другими металлами. Например, рубидий и цезий имеют температуры плавления около 39°C и 28°C соответственно, что делает их жидкими при комнатной температуре.
4. Мягкость и пластичность: щелочные металлы являются мягкими и пластичными. Они могут быть легко рассечены ножом или прокатаны в тонкую фольгу. Например, кусок калия можно рассечь ножом, а кусок цезия легко оставить отпечаток пальцем.
5. Хорошая электропроводность: щелочные металлы обладают высокой электропроводностью, что делает их полезными в области электротехники, включая производство батарей и проводов.
6. Образование оксидов: щелочные металлы легко образуют оксиды, такие как оксид лития (Li2O), оксид натрия (Na2O) и оксид калия (K2O). Эти оксиды широко используются в производстве стекла, керамики и других материалов.
7. Активность в органической химии: щелочные металлы также проявляют активность в органической химии, где они реагируют с органическими соединениями для образования новых веществ.
Источники:
- https://ru.wikipedia.org/wiki/Щелочные_металлы
- https://chemport.ru/chemistry/elementaristiki.элементы/щелочные-металлы/
Изменение точки плавления щелочных металлов
Точка плавления является одним из важных физических свойств металлов и является температурой, при которой твердое вещество переходит в жидкое состояние. Для щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и рубидий (Rb), точка плавления является характеристикой, которая изменяется в зависимости от температуры.
При повышении температуры, точка плавления щелочных металлов также повышается. Это связано с увеличением количества тепловой энергии, необходимой для разрушения кристаллической решетки и перехода в состояние жидкости. Более высокая точка плавления указывает на более сильные межатомные связи в кристаллической решетке и более высокую степень упорядочения структуры металла.
У всех щелочных металлов наблюдается общая тенденция увеличения точки плавления с увеличением атомного номера. Например, точка плавления лития составляет около 180 градусов Цельсия, в то время как точка плавления рубидия составляет около 40 градусов Цельсия. Это объясняется увеличением размеров атомов и соответствующим увеличением числа электронов в кристаллической решетке, что приводит к более сильным межатомным связям.
Также стоит отметить, что щелочные металлы обладают низкими плотностями, что делает их особенно интересными для различных применений. Изменение точки плавления щелочных металлов при изменении температуры может играть большую роль в таких областях, как производство сплавов и конструкционных материалов.
Зависимость точки плавления от температуры
Точка плавления щелочных металлов, таких как литий, натрий и калий, зависит от температуры. При повышении температуры, точка плавления щелочных металлов также повышается.
Изменение точки плавления щелочных металлов обусловлено их внутренней структурой и взаимодействием атомов в кристаллической решетке. При низких температурах атомы щелочных металлов образуют упорядоченную кристаллическую структуру, а при повышении температуры происходит нарушение этой структуры, что приводит к плавлению материала.
Для каждого щелочного металла существует конкретная температура, при которой происходит плавление. Например, точка плавления лития составляет около 180 градусов Цельсия, натрия – около 98 градусов Цельсия, а калия – около 64 градусов Цельсия.
Следует отметить, что точки плавления щелочных металлов являются относительно низкими по сравнению с другими металлами. Это связано с их низкой энергией связи и химической активностью.
- Литий (Li) – точка плавления: примерно 180 °C
- Натрий (Na) – точка плавления: примерно 98 °C
- Калий (K) – точка плавления: примерно 64 °C
Таким образом, точка плавления щелочных металлов является важной характеристикой, которая может быть использована при разработке материалов с определенными свойствами и в процессе их применения.
Вопрос-ответ
Как изменяется плотность щелочных металлов при повышении температуры?
При повышении температуры плотность щелочных металлов снижается. Это объясняется тем, что при нагревании атомы металла начинают двигаться быстрее, что приводит к увеличению расстояния между ними, а следовательно, к уменьшению плотности.
Какие щелочные металлы имеют самую низкую точку плавления?
Самую низкую точку плавления имеют литий (180,5°C) и калий (63,5°C). Это объясняется их слабой межатомной связью и низкой энергией решетки.
Почему щелочные металлы имеют низкую точку плавления?
У щелочных металлов низкая точка плавления связана с их слабой межатомной связью и низкой энергией решетки. В кристаллической решетке щелочных металлов атомы находятся на большом расстоянии друг от друга, что способствует легкому разрушению связей при нагревании и, как следствие, низкой точке плавления.
Есть ли зависимость между плотностью щелочных металлов и их точкой плавления?
Да, существует зависимость между плотностью щелочных металлов и их точкой плавления. Обычно металлы с более высокой плотностью имеют более высокую точку плавления. Это связано с тем, что более плотные металлы имеют более сильные межатомные связи, которые требуют больше энергии для их разрушения при нагревании.
Как зависит плотность щелочных металлов от температуры?
Плотность щелочных металлов обратно пропорциональна их температуре. Это означает, что при повышении температуры плотность металлов снижается, а при понижении температуры плотность увеличивается. Это связано с тем, что при нагревании атомы металла получают больше энергии, начинают двигаться быстрее и занимают больше объема, что приводит к снижению плотности.
