Оксиды являются химическими соединениями, содержащими кислород и элемент из периодической таблицы. Они играют важную роль в природе и промышленности благодаря своим разнообразным свойствам и применению. Одним из таких оксидов является K2O.
K2O - это химическое соединение калия (K) и кислорода (O). Калий является металлом, а кислород - неметаллом. Соединения, содержащие кислород и металлы, обычно называются оксидами металлов, в то время как соединения, содержащие кислород и неметаллы, называются оксидами неметаллов.
В случае K2O, кислород является неметаллом, поэтому можно предположить, что K2O - оксид неметалла. Однако, не стоит забывать, что вода (H2O) также содержит кислород и является оксидом неметалла, хотя вода - это жидкость, а не твердое вещество. Таким образом, классификация K2O как оксида металла или неметалла зависит от его физических и химических свойств.
Для окончательного определения классификации K2O, необходимо изучить его свойства и реакции с другими веществами.
К2О: вещество соединения металла и неметалла
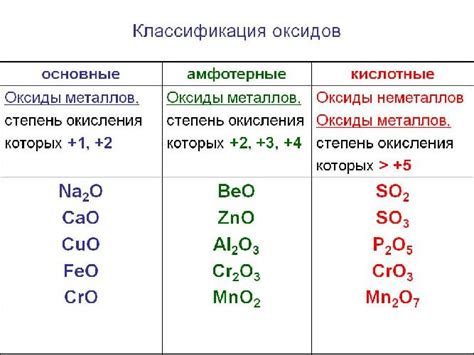
К2О является химическим соединением, состоящим из калия (металла) и кислорода (неметалла). Это оксид, который образуется при сочетании двух элементов в определенных пропорциях.
Калий (K) принадлежит к группе щелочных металлов и обладает химическими свойствами типичного металла, такими как высокая электропроводность и гибкость. Он является мягким металлом и активным элементом, способным реагировать с водой и воздухом.
Кислород (О) - один из основных неметаллов в периодической системе элементов. Он обладает высокой электроотрицательностью и образует свзяь с металлами, которая называется ионно-ковалентной связью.
Оксиды металлов и неметаллов являются одними из наиболее распространенных химических соединений. Они играют важную роль в различных сферах, таких как промышленность, электроника и медицина. К2О часто используется в качестве сырья для производства удобрений и стекол.
Неметаллический оксид, состоящий из двух элементов
Неметаллические оксиды - это химические соединения, состоящие из двух неметаллических элементов. Они образуются при соединении кислорода с другими неметаллами и имеют свои уникальные свойства.
Примерами неметаллических оксидов могут служить двуокись углерода (CO2), диоксид серы (SO2), трехокись азота (N2O3) и т. д.
Неметаллические оксиды обычно обладают характерной кислотной или основной реакционной способностью. Некоторые из них растворяются в воде и образуют кислотные растворы, а другие - образуют щелочные растворы.
Эти соединения могут использоваться в различных областях: в химической промышленности, энергетике, медицине и других. Неметаллические оксиды играют важную роль в формировании атмосферных явлений, таких как загрязнение воздуха и парниковый эффект.
- Двуокись углерода (CO2) - это неметаллический оксид, получаемый при сгорании углерода или органических соединений. Он является основным газом, вызывающим парниковый эффект и приводящий к изменению климата.
- Диоксид серы (SO2) - это неметаллический оксид, который образуется при сжигании серы или серосодержащих соединений. Он является одной из причин кислотного дождя и загрязнения воздуха.
- Трехокись азота (N2O3) - это неметаллический оксид, который образуется при реакции азотной кислоты с оксидом азота(I). Он используется в химической промышленности в качестве окислителя и в производстве различных соединений.
Неметаллические оксиды - важные соединения, которые имеют широкий спектр применения и оказывают значительное влияние на окружающую среду и человечество в целом.
Применение и свойства вещества K2O
K2O - это химическое соединение, которое состоит из ионов калия (K+) и оксида (O2-). Это белый порошок или кристаллы с сильным щелочным вкусом. K2O широко используется в различных отраслях промышленности и науки благодаря своим уникальным свойствам.
Одним из основных применений K2O является его использование в качестве катализатора. Это вещество активно вступает в реакцию с другими веществами, ускоряя химические процессы. K2O также широко применяется в производстве промышленных удобрений, так как является значительным источником калия, необходимого для роста растений.
Благодаря своей щелочной природе, K2O используется в производстве стекла и керамики. Оно способно взаимодействовать с кислородом, что позволяет улучшить качество и прозрачность стекла. K2O используется также в плазменной и ядерной физике, где его свойства активно применяются для получения высоких температур и высокой энергии.
Следует отметить, что K2O является реактивным веществом, которое может вызывать раздражение кожи и дыхательных путей. При работе с ним необходимо соблюдать все меры предосторожности и использовать соответствующие средства защиты.
Вопрос-ответ
Каково молекулярное строение K2O?
К2O является ионной соединительной сетью, где два иона калия (K+) образуют положительный катион, а один ион кислорода (O2-) образует отрицательный анион.
Какой тип соединения образует K2O?
K2O образует ионическое соединение.
Каким является оксид K2O - металлическим или неметаллическим?
Оксид K2O является неметаллическим соединением.
Какие элементы входят в состав оксида K2O?
Оксид K2O состоит из атомов калия (K) и кислорода (O).
K2O - это оксид какого элемента?
K2O - это оксид элемента калий (K).
Каковы свойства и использование оксида K2O?
Оксид K2O имеет высокую термическую стабильность и используется в качестве катализатора, сырья для производства стекла и керамики.
Влияет ли K2O на окружающую среду?
Раствор оксида K2O в воде может быть весьма щелочным и оказывать неблагоприятное воздействие на окружающую среду в больших концентрациях.
