Взаимодействие различных металлов может привести к возникновению гальванической пары, проявляющейся в форме электрохимической реакции. Гальваническая пара возникает, когда два разных металла находятся в контакте друг с другом и погружены в раствор электролита. В такой системе один из металлов, называемый активным, растворяется, а другой металл, называемый пассивным, не изменяет своего состояния.
При взаимодействии разных металлов в гальванической паре происходит течение электронов от активного металла к пассивному через электролит. Это связано с разницей в электрохимических потенциалах металлов, которая обусловлена их различной способностью отдавать или принимать электроны. Поэтому активный металл окисляется, а пассивный металл восстановливается.
В результате гальванической пары образуется электрический ток, который может использоваться для осуществления различных процессов. Например, в батареях гальваническая пара способна обеспечить постоянное электропитание, а в гальванической коррозии гальваническая пара приводит к разрушению металла активной части.
Понятие гальванической пары
Гальваническая пара представляет собой систему, состоящую из двух различных металлов или сплавов, погруженных в электролит и соединенных проводником. Такая система позволяет осуществлять превращение химической энергии в электрическую.
Гальваническая пара образуется при взаимодействии различных металлов или сплавов, которые обладают разными потенциалами окисления. В такой системе происходит электрохимическая реакция, при которой один металл становится анодом (положительным электродом), а другой – катодом (отрицательным электродом).
Гальваническая пара функционирует благодаря разнице потенциалов между двумя металлами или сплавами. При погружении в электролит образуется электронная разность, которая приводит к движению электронов через проводник, а ионы металлов перемещаются через электролит в противоположные электроды.
При гальванической реакции на аноде происходит окисление металла, при котором он отдает электроны. На катоде же происходит восстановление металла, куда поступают электроны от анода через внешнюю цепь. Таким образом, в гальванической паре происходит непрерывное электрическое течение.
Определение гальванической пары
Гальваническая пара представляет собой систему из двух различных металлов или металла и полупроводника, погруженных в электролит. Эти два материала называются электродами пары.
При образовании гальванической пары между электродами возникает разность потенциалов, которая приводит к протеканию электрического тока через внешнюю цепь. Этот процесс основан на различных электрохимических свойствах металлов и продуктах их взаимодействия с электролитом.
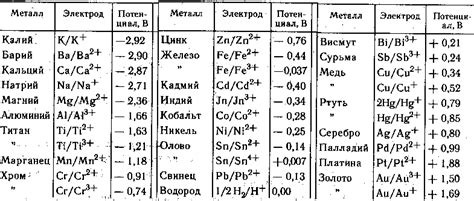
Для определения гальванической пары необходимо знать аномальный ряд напряжений металлов. В этом ряду металлы упорядочены по возрастанию их потенциала окисления. Для определения пары нужно выбрать два металла с различными значениями их потенциала окисления.
Гальванические пары широко используются в различных сферах, включая электрохимию, такие как батареи и аккумуляторы, электропитание, катодная защита, а также в различных электрохимических процессах, включая электролиз и гальваностегия.
Знание о гальванической паре и ее взаимодействии с электролитом позволяет установить условия работы системы, определить реакции и улучшить эффективность электрохимических процессов.
Примеры гальванических пар
Гальваническая пара представляет собой систему, состоящую из двух различных металлов или полупроводников, проницаемых ионами. При контакте этих двух материалов в присутствии электролита возникает потенциал и начинается аномальная миграция электронов.
Одним из наиболее известных и широко используемых примеров гальванических пар является пара цинк-медь. При соединении цинка и меди в электролите (например, соляной кислоте) цинк начинает активно окисляться, отдавая электроны. Медь, в свою очередь, принимает эти электроны, происходя при этом восстановление меди. Таким образом, цинк окисляется, а медь восстанавливается.
Еще одним примером гальванической пары является пара железо-медь. При соединении железа и меди в электролите (например, серной кислоте) на поверхности железа происходит окисление, а на поверхности меди — восстановление. Таким образом, железо окисляется, а медь восстанавливается.
Гальванические пары находят применение в различных областях, например, в производстве аккумуляторов, электрохимических сенсорах и электростанциях. Исследование и понимание гальванических пар помогает улучшить эффективность таких систем и разработать новые технологии в области энергетики и электрохимии.
Процесс взаимодействия разных металлов
Взаимодействие разных металлов в гальванической паре представляет собой процесс, при котором происходит электрохимическая реакция между двумя металлами. При этом один металл действует как анод, а другой - как катод.
Такая реакция возникает из-за разности потенциалов между металлами. Металл с более высоким потенциалом, т.е. более активный металл, будет выступать в качестве анода и окисляться. Более низкопотенциальный металл, катод, будет получать электроны, что приведет к его восстановлению.
Процесс взаимодействия разных металлов может использоваться для создания гальванических элементов и батарей. Примером такой реакции является гальванический элемент, состоящий из цинка (анод) и меди (катод). При соединении этих металлов в электролите, происходит поток электронов от цинка к меди, что вызывает генерацию электрического тока.
Важно отметить, что при взаимодействии разных металлов может возникать растворение анода. Это связано с тем, что реакция окисления металла на аноде происходит с образованием ионов металла, которые растворяются в электролите. Этот процесс получил название коррозии. Для снижения коррозии и увеличения стабильности гальванической пары могут использоваться специальные защитные покрытия и антикоррозионные добавки.
Механизм гальванической реакции
Гальваническая реакция является процессом переноса электронов между разными металлами, происходящим в присутствии электролита. Этот процесс основан на разности электрохимического потенциала разных металлов и является основой работы гальванических элементов и батарей.
Механизм гальванической реакции состоит из нескольких этапов. Первоначально происходит окисление одного металла, который отдает электроны и превращается в положительно заряженный ион. Эти электроны перемещаются по внешней цепи к второму металлу, который выступает в качестве восстановителя и принимает электроны.
В результате этой реакции происходит разделение зарядов и образование электрического тока. Электроны, перемещаясь по внешней цепи, создают электрическую разность потенциалов, что позволяет использовать эту энергию для работы различных устройств и систем, подключенных к гальваническому элементу.
Помимо электронного переноса, также происходит перенос ионов в электролите. Реакции окисления и восстановления, а также движение ионов, связанное с этими процессами, происходят параллельно и обеспечивают установление электрохимического равновесия в системе.
Полярность взаимодействующих металлов
Взаимодействие разных металлов происходит в рамках гальванической пары. В этом процессе один металл будет выступать в роли анода, а другой - в роли катода. Определение, какой металл будет анодом, а какой катодом, зависит от их полярности.
Полярность металлов определяется их потенциалами окисления. Металлы с более низким потенциалом окисления являются анодами, так как они способны образовывать положительные ионы и подвергаться окислению. Металлы с более высоким потенциалом окисления, наоборот, являются катодами, так как они способны принимать положительные ионы и подвергаться восстановлению.
Полярность важна для корректной работы гальванической пары. Если металлы с разной полярностью будут взаимодействовать, возникнет потенциал для электрического тока. Такой ток может использоваться для выполнения различных полезных задач, например, для приведения в движение электрического устройства или для защиты металлов от коррозии.
Изучение полярности металлов взаимодействующих гальванической парой помогает понять, какие металлы будут эффективно работать в совместной системе и как будет протекать реакция. Это позволяет определить возможность создания электрического потенциала, а также выбрать металлы, которые будут наиболее устойчивы к коррозии и механическому износу в заданной среде.
Практическое применение гальванической пары
Гальваническая пара, состоящая из двух разных металлов, может быть использована для различных практических целей. Одним из наиболее распространенных применений гальванической пары является использование ее в аккумуляторах. Аккумуляторы используют разность потенциалов между двумя металлами, чтобы сохранять и выдавать электрическую энергию.
Гальваническая пара также может использоваться для защиты от коррозии. Например, в случае использования алюминия и цинка в гальванической паре, цинк будет служить анодом, которому будет предпочтительнее окисляться, алюминия же будет служить катодом. Это позволяет предотвратить коррозию алюминия, так как цинк будет окисляться вместо него.
Еще одним практическим применением гальванической пары является ее использование в процессе гальванизации. Гальванизация применяется для покрытия предметов металлическим слоем, чтобы защитить их от коррозии, а также придать им декоративный вид. Например, при гальванизации железа или стали и использовании меди в качестве второго металла, получается покрытие из меди, которое является прочным, защищает от окисления и придает изделию привлекательный внешний вид.
Гальваническая пара также находит применение в процессе электролиза. Электролиз используется для разделения веществ, основанных на разности окислительно-восстановительного потенциала. В этом процессе различные металлы могут быть использованы в качестве анода и катода для расщепления молекул веществ.
Гальваническая коррозия
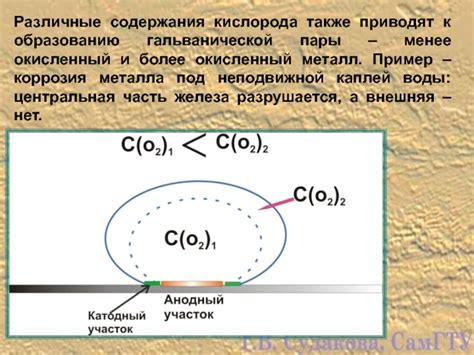
Гальваническая коррозия – это вид электрохимической коррозии, возникающий при взаимодействии разных металлов в электролите. Основным фактором, приводящим к гальванической коррозии, является разность электрохимического потенциала между металлами.
При создании гальванической пары металл с более низкой электрохимической активностью (анод) начинает выделять электроны, которые переносятся через электролит к металлу с более высокой активностью (катоду). Это приводит к тому, что анодный металл начинает корродироваться, а катодный металл остается незатронутым.
Гальваническая коррозия может быть особенно интенсивной при наличии влажной среды, а также в присутствии морской воды или других электролитов, содержащих соли.
Если металлы соединены электролитической проводимостью, то гальваническая коррозия может быть электрически усиленной. Этот процесс называется гальванической защитой. Она заключается в создании специальной гальванической пары, где металл с более высокой электрохимической активностью выступает в качестве анода, защищая основной металл от коррозии.
Гальваническая защита

Гальваническая защита - метод борьбы с коррозией металлов, основанный на создании гальванической пары между двумя разными металлами. Один из металлов выступает в роли анода, а другой - в роли катода.
Процесс гальванической защиты основан на том, что в паре разных металлов один из них является более активным и электроотрицательным, а другой - менее активным и электроположительным. В результате возникает потенциал разности электродов, который приводит к протеканию электрического тока между металлами. Это в свою очередь позволяет сохранить металл, выступающий в роли катода, от коррозии и повреждений, тогда как металл, выступающий в роли анода, подвергается коррозии.
Гальваническая защита применяется в различных сферах, включая строительство, машиностроение и промышленность. Например, при защите подводных конструкций от коррозии используется метод гальванической защиты - основные металлические детали соединяются с анодами из менее активного металла, что позволяет сохранить подводные системы и сооружения в целостности.
Гальваническая защита является эффективным методом предотвращения коррозии металлов и продлевает срок службы конструкций. Однако, для успешной работы этой системы необходимо тщательно подбирать пару металлов с разной электрохимической активностью и контролировать условия окружающей среды.
Вопрос-ответ
Какое значение имеет гальваническая пара металлов?
Гальваническая пара представляет собой электрохимическую систему, в которой два различных металла находятся в контакте с раствором электролита. В результате их взаимодействия происходит перенос электронов между металлами и электролитом, что обусловливает токовую активность металлов и возможность возникновения коррозии.
Какие металлы могут образовывать гальваническую пару?
Гальваническая пара может образовываться из любых двух различных металлов, которые находятся в контакте друг с другом и окружены раствором электролита. Некоторые известные примеры гальванических пар: железо и медь, алюминий и олово, никель и кадмий и т.д.
Что происходит при взаимодействии двух металлов в гальванической паре?
При взаимодействии двух металлов в гальванической паре происходит перенос электронов от одного металла к другому через раствор электролита. Металл, который отдает электроны, называется анодом, а металл, который принимает электроны, называется катодом. Этот процесс называется гальванической реакцией. В результате реакции обычно образуется разница потенциалов между металлами, что может приводить к коррозии более активного металла.
Каков механизм протекания гальванической реакции?
Механизм протекания гальванической реакции связан с различными электрохимическими потенциалами разных металлов. Более активный металл, имеющий более низкий электрохимический потенциал, теряет электроны и выступает в роли анода. Более пассивный металл, имеющий более высокий электрохимический потенциал, принимает электроны и выступает в роли катода. Таким образом, электроны переносятся от анода к катоду через раствор электролита, что вызывает протекание гальванической реакции.
