Взаимодействие галогенов с металлами, такими как железо (Fe), и хлоридом (Cl2) является важной темой в химии. Галогены - это элементы 17-й группы периодической системы, включающие фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At). Они обладают высокой электроотрицательностью и сильной окислительной способностью, что делает их интересными для исследования и взаимодействия с металлами.
В химии галогены часто реагируют с металлами, образуя галогениды металлов. В случае с металлом железа (Fe) и хлоридом (Cl2), основной реакцией является образование хлорида железа (FeCl2). Эта реакция происходит под действием тепла или просто при комнатной температуре, и она является экзотермической, то есть сопровождается выделением тепла.
Хлорид железа (FeCl2) является важным веществом в химической промышленности и используется в процессах, связанных с оловом, кобальтом и другими веществами. Он обладает кристаллической структурой и является растворимым в воде. При взаимодействии с водой образуется раствор, обладающий желтовато-зеленоватым оттенком. Также хлорид железа (FeCl2) имеет магнитные свойства и может применяться в магнитных технологиях.
Взаимодействие галогенов с металлами

Галогены - это группа элементов периодической системы, включающая фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At). Эти элементы не только обладают высокой химической реактивностью, но и способны взаимодействовать с различными металлами, включая железо (Fe), алюминий (Al), медь (Cu) и другие.
Взаимодействие галогенов с металлами происходит путем образования солей. Например, галогены могут реагировать с иодидами металлов, образуя соответствующие хлориды, бромиды или фториды металлов. Эти реакции особенно интенсивны с железом и хлором.
Важно отметить, что реактивность галогенов с металлами различна и зависит от химических свойств галогена. Например, фтор является самым реактивным галогеном и может образовывать соединения с множеством металлов. Хлор взаимодействует с металлами не так интенсивно, как фтор, но все равно образует стабильные и прочные хлориды металлов.
Взаимодействие галогенов с металлами может быть полезным в различных областях химии и промышленности. Например, образование галогенидов металлов может использоваться в процессах очистки воды и в производстве лекарственных препаратов.
Кроме того, галогены также могут вызывать коррозию металлов и быть опасными для человеческого здоровья. Поэтому необходимо соблюдать меры предосторожности при обращении с галогенами и их соединениями.
Химические свойства галогенов
Галогены - это элементы VII группы периодической системы, к которым относятся фтор (F), хлор (Cl), бром (Br) и йод (I). Они обладают сходными химическими свойствами и отличаются от других элементов благодаря наличию семи валентных электронов в своей внешней оболочке.
Галогены являются сильными окислителями и легко вступают в реакции с металлами, образуя соли - галогениды. Например, хлор реагирует с натрием, образуя хлорид натрия (NaCl). Эти соединения обладают высокой электроотрицательностью и обычно имеют сильно разрушающий эффект на другие соединения.
Галогены также обладают высокой растворимостью в воде и образуют кислотные растворы. Например, раствор хлора образует соляную кислоту (HCl) при контакте с водой. Эти растворы обладают характерными свойствами кислот, такими как способность к образованию ионов водорода (H+) и реакции с щелочами и металлами.
Галогены также могут образовывать соединения с другими легкими элементами, такими как кислород и сера. Например, хлор образует оксид хлора (Cl2O) и оксид хлора (V) (Cl2O7), а бром - оксид брома (Br2O) и оксид брома (V) (Br2O5). Эти соединения могут быть использованы в различных промышленных процессах и химических реакциях.
В целом, галогены обладают широким спектром химических свойств и могут быть использованы в различных областях химической промышленности и научных исследований.
Химические свойства металлов

1. Химическая активность: Металлы обладают высокой химической активностью, что проявляется в их способности образовывать химические соединения с другими элементами. Например, большинство металлов легко реагируют с кислородом воздуха, образуя оксиды.
2. Окисление: Металлы могут подвергаться окислению, то есть реагировать с кислородом и образовывать оксиды. Окисление металлов может быть как наблюдаемым процессом на поверхности металла (например, образование ржавчины на железе), так и внутренним процессом (например, окисление металлов в реакциях с кислородом воздуха или водой).
3. Реакция с кислотами: Многие металлы реагируют с кислотами, выделяя водород. Например, железо реагирует с соляной кислотой по следующему уравнению: Fe + 2HCl → FeCl2 + H2.
4. Реакция с галогенами: Некоторые металлы, такие как железо и хлор, могут взаимодействовать и образовывать соединения. Например, соединение FeCl2 происходит из реакции железа с хлором по уравнению: Fe + Cl2 → FeCl2.
5. Способность образовывать сплавы: Металлы могут образовывать сплавы путем смешивания с другими металлами или неметаллами. Сплавы обладают различными свойствами, которые могут быть полезными в различных областях, например, в инженерии и строительстве.
6. Электрохимическая активность: Металлы могут быть активными электрохимическими агентами, они могут служить как анодами, выделяя электроны, или как катодами, принимая электроны. Это свойство металлов широко используется в электротехнике и батареях.
7. Проводимость электричества и тепла: Многие металлы обладают хорошей проводимостью электричества и тепла, что делает их полезными в электротехнике и теплообменных устройствах, таких как радиаторы.
Взаимодействие металлов Fe-Cl2
Металлы Fe-Cl2, то есть железо и хлор, обладают способностью активно взаимодействовать друг с другом, образуя различные химические соединения. Важно отметить, что взаимодействие металлов Fe-Cl2 является экзотермическим процессом, что означает выделение тепла в результате проведения реакции. Данное взаимодействие является основой для получения широко используемого химического соединения - хлорида железа (III).
В процессе взаимодействия металлов Fe-Cl2 происходит окислительно-восстановительная реакция, при которой ионы железа Fe переходят в более высокую степень окисления, а ионы хлора Cl2 - в более низкую. В такой реакции ионы Fe принимают электроны от ионов Cl2, что приводит к образованию ионов Fe3+ и ионов Cl-. Эти ионы образуют кристаллическую решетку хлорида железа (III).
Химическое соединение FeCl3, образующееся в результате взаимодействия металлов Fe-Cl2, обладает интересными свойствами и находит широкое применение в различных областях. Например, FeCl3 используется в качестве катализатора при многих органических реакциях, а также в процессе производства электроники и гальваники. Кроме того, феррихлорид железа имеет свойства окислителя и используется в процессах очистки воды и обработки отходов.
Особенности взаимодействия галогенов с металлами

1. Образование индивидуальных соединений. Галогены, такие как фтор (F), хлор (Cl), бром (Br) и йод (I), могут образовывать индивидуальные соединения с металлами, включая железо (Fe). Эти соединения обладают своими уникальными свойствами и могут использоваться в различных областях науки и промышленности.
2. Образование солей галогенидов. Галогены могут также образовывать соли галогенидов со многими металлами, включая Fe. Эти соединения имеют решающее значение для формирования различных материалов, включая керамику, стекло и комплексные сплавы.
3. Реакции окисления и редукции. Галогены могут быть как окислителями, так и восстановителями в реакциях с металлами. Они могут окислять металлы, например, в формировании оксидов металла, а также восстанавливать металлы, например, в формировании галогенидов. Эти реакции могут быть использованы для получения ценных продуктов и материалов.
4. Влияние галогенов на свойства металлических материалов. Взаимодействие галогенов с металлами, такими как железо, может значительно изменить их физические и химические свойства. Например, взаимодействие хлора с железом может привести к образованию железо(III) хлорида, который обладает другими механическими и электрохимическими свойствами по сравнению с чистым железом.
5. Токсичность и опасность. Некоторые галогены, особенно фтор (F) и хлор (Cl), могут быть токсичными и опасными для здоровья человека и окружающей среды. Поэтому необходимо проявлять осторожность при обращении с галогенами и соединениями металлов галогенидов, чтобы минимизировать риски для здоровья и окружающей среды.
- Вывод 1
- Вывод 2
- Вывод 3
Реакции при взаимодействии галогенов с металлами Fe-Cl2
Галогены - это химические элементы, включающие фтор (F), хлор (Cl), бром (Br) и йод (I). Взаимодействие галогенов с металлами, такими как железо (Fe) и хлор (Cl2), приводит к различным реакциям и образованию разных соединений.
Одной из наиболее известных реакций галогенов с железом и хлором является реакция образования хлорида железа (FeCl2). При этой реакции флюктуация электронов в молекулах галогена позволяет им образовать ионные связи с металлами. В результате образуется стабильное соединение - хлорид железа.
Взаимодействие галогенов с металлами Fe-Cl2 также может привести к образованию комплексных соединений. Например, с образованием комплексов хлорида железа, которые содержат галогенные лиганды. Эти соединения обладают различными физическими и химическими свойствами и могут использоваться в различных областях, включая катализ, медицину и промышленность.
Одна из других реакций при взаимодействии галогенов с металлами Fe-Cl2 - это окисление железа. Галогены могут окислить железо, освобождая электроны и образуя ионы галогенов. Этот процесс может быть реакцией соли железа (II) и галогена или смешиванием галогена с порошком железа.
Все эти реакции галогенов с металлами Fe-Cl2 имеют широкий спектр применения в различных областях, включая химическую и фармацевтическую промышленность, аналитическую химию и исследования в области материалов. Изучение этих реакций позволяет получать новые соединения и разрабатывать новые методы синтеза с высокой эффективностью и специфичностью.
Практическое применение взаимодействия галогенов с металлами Fe-Cl2
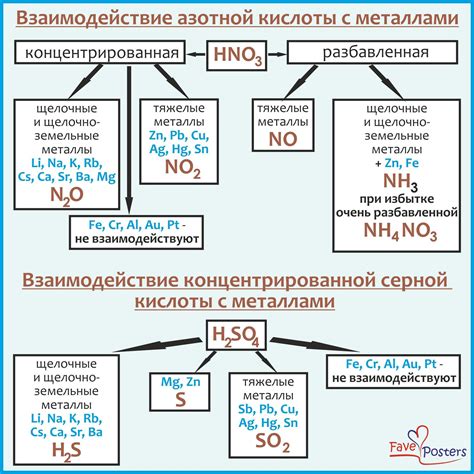
Взаимодействие галогенов с металлами Fe-Cl2 имеет широкое практическое применение в различных областях. Одним из важных направлений использования этого взаимодействия является производство хлорида железа (III) - вещества, которое находит применение в медицине, металлургии, производстве красителей, смазочных материалов и других отраслях промышленности.
Галогены позволяют получать хлорид железа (III) путем окисления ионов железа (II) до ионов железа (III). Этот процесс особенно востребован в медицине для получения препаратов, предназначенных для лечения анемии и других заболеваний, связанных с дефицитом железа в организме. Кроме того, хлорид железа (III) применяется в металлургии для обработки стали, повышения ее прочности и жаропрочности.
Также, взаимодействие галогенов с металлами Fe-Cl2 находит применение в производстве красителей, особенно для текстильной и пищевой промышленности. Полученный хлорид железа (III) является важным компонентом для создания различных цветных пигментов, которые применяются для окрашивания тканей и пищевых продуктов.
Более того, взаимодействие галогенов с металлами Fe-Cl2 используется при производстве смазочных материалов. Хлорид железа (III) добавляется в состав масел и смазок для улучшения их антикоррозийных свойств и защиты от ржавения. Такие смазочные материалы широко применяются в транспортной отрасли и промышленности в целом, где требуется эффективная защита механизмов от негативного воздействия окружающей среды.
Вопрос-ответ
Какие особенности взаимодействия галогенов с металлами Fe-Cl2?
При взаимодействии галогенов с металлами Fe-Cl2 происходят различные реакции, в результате которых образуются соответствующие хлориды. Важным аспектом этого процесса является способность галогенов к окислению железа, что приводит к образованию соответствующих хлоридов.
Какие реакции возможны при взаимодействии галогенов с металлами Fe-Cl2?
При взаимодействии галогенов с металлами Fe-Cl2 возможны следующие реакции: образование соответствующих хлоридов (например, FeCl3), окисление железа, образование комплексных соединений металла с галогенами и др.
Каким образом галогены окисляют железо в реакциях с металлами Fe-Cl2?
Галогены окисляют железо в реакциях с металлами Fe-Cl2 посредством переноса электронов. Галогены имеют большую электроотрицательность, поэтому они обладают способностью принимать электроны от железа, что приводит к окислительным свойствам галогенов.
Какие соединения образуются при взаимодействии галогенов с металлами Fe-Cl2?
При взаимодействии галогенов с металлами Fe-Cl2 образуются соответствующие хлориды. Например, при взаимодействии хлора с металлами Fe-Cl2 образуется хлорид железа (FeCl3). Также возможно образование комплексных соединений металла с галогеном, которые обладают особыми свойствами и находят применение в различных областях науки и техники.

