Фосфор – химический элемент с атомным номером 15. Он принадлежит к группе пневмогидридов и является жизненно важным элементом для всех организмов. Однако, когда речь идет о его классификации – металл он или неметалл, возникает определенное замешательство.
На первый взгляд, фосфор представляет собой нетипичный металл, так как он обладает химическими свойствами, характерными для неметаллов. Например, он образует кислотные оксиды и проявляет амфотерные свойства. Кроме того, у него низкая температура плавления и вяжущая способность. Все это характеризует его как неметалл.
Однако, фосфор также имеет свойства, присущие металлам. Например, он способен проводить электрический ток, образовывать положительно заряженные ионы, обладает металлическим блеском и может образовывать сплавы с другими металлами. Кроме того, он обладает достаточно большой плотностью и твердостью, что приводит к его употреблению в различных технологических процессах.
Итак, классификация фосфора не столь очевидна. Он является элементом, объединяющим в себе как некоторые свойства металлов, так и неметаллов. Поэтому его можно считать средним по своим химическим свойствам. Однако, химический элемент всегда имеет свои нюансы, и фосфор – не исключение.
Фосфор: общая информация

Фосфор - это химический элемент с порядковым номером 15 в таблице Mendeleev и обозначением Р. Он относится к группе элементов, называемых пневмогенами или самоотдельчайми. Фосфор является многосоставной веществом, что означает, что он может существовать в разных структурных формах, известных как аллотропы.
Фосфор - важный элемент для жизни, поскольку он является ключевым компонентом ДНК, РНК и АТФ, основного источника энергии, используемого клетками. Этот элемент также присутствует в структуре фосфолипидов, которые образуют клеточные мембраны.
Фосфор имеет высокую реакционность и может быть найден в природе в соединениях с другими элементами, такими как кальций, магний и кислород. Он представляет собой твердое вещество белого цвета, которое может образовывать два основных аллотропа: красный и белый фосфор.
Красный фосфор является менее реактивной формой, а белый фосфор является более реакционным. Белый фосфор может загореться при контакте с воздухом, поэтому он должен храниться под водой или в другой инертной среде.
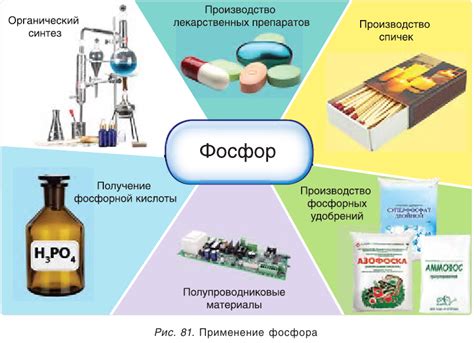
Фосфор используется в различных отраслях, включая сельское хозяйство, производство удобрений, фармацевтику и производство огнестрельных патронов. Он также используется в производстве спеченных металлов и одного из самых блестящих искусственных камней - синего фосфора.
Физические свойства фосфора
Фосфор - химический элемент с атомным номером 15 и символом P. Он имеет несколько физических свойств, которые делают его уникальным.
Фосфор является неметаллом и находится в 15-й группе периодической таблицы. Он обладает светоносными свойствами и при взаимодействии с кислородом может излучать характерный зеленый свет. Это свойство фосфора делает его полезным в различных промышленных и научных приложениях.
Фосфор имеет несколько различных аллотропных форм, что означает, что он может существовать в разных формах с различными свойствами. Наиболее распространенные формы фосфора - белый и красный. Белый фосфор является самым стабильным и обычно найденным в природе. Он имеет желтый цвет и ядовитый пар, поэтому требует особого обращения. Красный фосфор, с другой стороны, является более стабильным и менее реактивным, и используется, например, в производстве спичек.
Фосфор обладает высокой плотностью и твердостью. Его плотность составляет около 1,8 г/см³, что делает его одним из самых тяжелых химических элементов. Он также обладает высокой точкой плавления и кипения, соответственно около 44 °C и 280 °C.
Фосфор хорошо растворим в некоторых органических растворителях, но практически не растворим в воде. Он имеет высокую электроотрицательность и может образовывать различные химические соединения с различными элементами.
Химические свойства фосфора

Фосфор – элемент химической системы, обладающий множеством уникальных свойств. Его химические свойства определяют его важность в различных областях науки и промышленности.
Фосфор является твердым веществом, обладающим хрупкой структурой. Он имеет большое количество различных аллотропов, которые отличаются по своим свойствам и структуре. Наиболее известным аллотропом фосфора является белый фосфор, который обычно находится в стабильном состоянии при нормальных условиях. Белый фосфор обладает высокой реактивностью и может гореть на воздухе. Он является ядовитым и может причинить серьезные ожоги при контакте с кожей.
Фосфор обладает способностью образовывать химические соединения с различными элементами. Самой известной и важной группой соединений фосфора являются фосфаты. Фосфаты широко используются в сельском хозяйстве в качестве удобрений, так как представляют собой важные источники фосфора для растений. Кроме того, фосфаты также используются в производстве стекла, детергентов, лекарств, пищевых добавок и многих других продуктах.
Фосфор также способен образовывать соединения с металлами, такими как алюминий, магний и железо. Эти соединения обладают различными свойствами и находят применение в разных областях. Например, соединение фосфора с железом, называемое феррофосфором, используется в производстве стали для придания ей дополнительных прочностных характеристик.
В целом, химические свойства фосфора делают его незаменимым элементом во многих отраслях науки и промышленности. Благодаря своей реактивности и способности образовывать соединения с разными элементами, фосфор представляет огромный интерес для исследователей и специалистов в различных областях.
Фосфор как элемент в природе
Фосфор является неотъемлемым элементом в природе и встречается в различных формах. Он находится в составе множества минералов, таких как апатит, фосфорит и вивианит. Минералы, содержащие фосфор, являются основой для добычи этого элемента.
Фосфор также является частью живых организмов. Он является ключевым компонентом ДНК, РНК и АТФ - основных молекул, отвечающих за передачу генетической информации и хранение энергии. Фосфор присутствует во всех клетках организмов и является необходимым для многих биохимических процессов.
Фосфор также играет важную роль в экосистемах. Он является одним из ограничивающих факторов для роста растений и влияет на их развитие. Фосфорный цикл в природе включает в себя процессы выщелачивания, восполнения и рециклинга. В результате, фосфор циркулирует между почвой, водой и живыми организмами.
Благодаря своим химическим свойствам, фосфор также широко используется в промышленности. Он является неотъемлемой частью удобрений, фармацевтических препаратов, пластмасс и других химических продуктов. Применение фосфора основывается на его реакционной способности и способности образовывать стабильные соединения с другими элементами.
Использование фосфора в промышленности

Фосфор является важным элементом в различных отраслях промышленности. Его основные применения связаны с его химическими свойствами, такими как способность образовывать соединения с другими элементами.
1. Производство удобрений: Фосфор используется в качестве основного компонента при производстве минеральных удобрений. Он является необходимым элементом для растений, так как способствует их росту и развитию. Фосфорные удобрения повышают плодородие почвы и увеличивают урожайность.
2. Производство пищевых добавок: Фосфорные соединения используются в пищевой промышленности в качестве добавок, например, в качестве стабилизаторов или смягчителей. Они могут использоваться в производстве мороженого, сыров, мясных продуктов и других пищевых товаров.
3. Производство стекла: Фосфорные соединения добавляются в процесс производства стекла для придания ему определенных химических и физических свойств. Фосфор помогает улучшить прозрачность стекла, снизить температуру его плавления и улучшить его химическую стойкость.
4. Производство металлических сплавов: Фосфор используется в процессе производства металлических сплавов, таких как латунь и бронза. Фосфор позволяет улучшить прочность и коррозионную стойкость сплавов, а также повысить их электропроводность и прочие химические свойства.
5. Производство дезинфицирующих средств: Фосфорные соединения используются в производстве различных дезинфицирующих средств, таких как дезинфицирующие растворы, средства для очистки воды и другие антисептические препараты. Эти соединения обладают свойствами, позволяющими нейтрализовать бактерии, вирусы и другие микроорганизмы.
Использование фосфора в промышленности имеет огромное значение и необходимо для производства многих продуктов, которые широко используются в повседневной жизни. Этот элемент поддерживает различные отрасли промышленности и способствует развитию экономики.
Биологическая роль фосфора
Фосфор является одним из наиболее распространенных элементов в биологических системах. Он играет важную роль во множестве биологических процессов и является необходимым для жизни всех организмов.
Фосфор является основным компонентом нуклеиновых кислот, таких как ДНК и РНК, которые являются основой генетической информации и участвуют в передаче наследственных признаков.
Фосфор также является важной составной частью АТФ (аденозинтрифосфата), который является основным источником энергии для многих клеточных процессов. Без АТФ клетки не могут выполнять свои функции и сохранять жизнеспособность.
Фосфор также участвует в образовании костей и зубов. Он является неотъемлемой составной частью гидроксиапатита - основного компонента костей и зубов, который придает им прочность и твердость.
Кроме того, фосфор участвует в регуляции метаболических процессов, включая синтез белков и липидов, передачу нервных импульсов и свертывание крови.
Таким образом, фосфор играет важную роль в биологических системах, обеспечивая правильное функционирование клеток и организмов.
Значение фосфора для человека

Фосфор – один из самых важных элементов, необходимых для нормального функционирования организма человека. Он играет ключевую роль во многих процессах, оказывая положительное влияние на здоровье человека.
Строительный материал. Фосфор является важной составной частью костных тканей и зубов. Он участвует в процессе минерализации костей, содействуя их росту и развитию. Благодаря фосфору мы можем сохранять крепкие кости и здоровые зубы.
Энергия и обмен веществ. Фосфор играет ключевую роль в процессе обмена веществ. Он участвует в синтезе и разрушении фосфорорганических соединений, что позволяет организму получать и использовать энергию из пищи. Фосфор также регулирует уровень pH крови, что необходимо для поддержания нормальной работы организма.
Нервная система и мозг. Фосфор влияет на нормальное функционирование нервной системы и мозга. Он участвует в передаче нервных импульсов, что позволяет нам чувствовать и реагировать на окружающую среду. Фосфор также необходим для синтеза гормонов и нейромедиаторов, которые регулируют работу мозга.
Кроме того, фосфор играет роль в процессе кроветворения, иммунном ответе организма, регулировании роста и развития клеток. Ежедневное потребление фосфора через пищу или в виде дополнений поможет поддерживать здоровье костей, укреплять иммунную систему, повышать метаболический процесс и обеспечивать нормальное функционирование организма в целом.
Вопрос-ответ
Фосфор – металл или неметалл?
На самом деле, фосфор является химическим элементом из группы не металлов. Он имеет атомный номер 15 в периодической системе элементов и обозначается символом Р. Фосфор является хрупким и хрупким веществом, которое может быть найдено в различных формах, включая белый и красный фосфор, фосфор черной и фосфорное стекло. Он обладает высокой химической активностью и широко используется в промышленности и сельском хозяйстве.
Возможно ли сделать фосфор металлическим?
Фосфор --- химический элемент, который изначально является неметаллом. Однако, при определенных условиях, его можно превратить в металл. К примеру, при высоком давлении и плавлении, часть атомов фосфора может реорганизоваться в металлическую структуру. Таким образом, фосфор может быть обнаружен в металлической форме, хотя он преимущественно является неметаллом.
В чем разница между белым и красным фосфором?
Белый и красный фосфор представляют различные физические модификации этого химического элемента. Белый фосфор представляет собой транслюсцентный, воспламеняющийся и токсичный материал. Он имеет мягкий восковидный состояние до 44 градусов Цельсия, после чего становится твердым и хрупким. Красный фосфор, напротив, является более стабильным и не токсичным. Он имеет темно-красный цвет и является инертным к химическим реакциям. Белый фосфор может быть превращен в красный фосфор путем нагревания до 300 градусов Цельсия или под действием давления.
Как фосфор используется в индустрии?
Фосфор имеет широкое применение в различных отраслях промышленности. Он используется для производства изделий из стекла и керамики, а также в сельском хозяйстве для производства удобрений и пестицидов. Фосфорные соединения также используются в производстве моющих средств, стиральных порошков, огнетушителей и других химических продуктов. Кроме того, фосфор используется в производстве сплавов и литейных материалов, а также в электронике для создания полупроводниковых устройств.