Коррозия – это непередача окислительного действия на металл, что приводит к разрушению материала. Одним из наиболее распространенных типов коррозии является химическая коррозия, которая происходит под воздействием влаги или агрессивных химических веществ. Однако существует и другой тип коррозии – электрохимическая, который происходит при взаимодействии металла с водой или раствором электролита. В данной статье рассмотрим отличия электрохимической коррозии от химической.
Главное отличие электрохимической коррозии от химической заключается в наличии электрического тока, создаваемого химической реакцией между металлом и окружающей средой. Под воздействием этого тока происходит перенос зарядов и взаимодействие с ионами в растворе, что вызывает разрушение металла.
В отличие от химической коррозии, электрохимическая коррозия происходит только при наличии в растворе электролита, способного проводить электрический ток. При этом водная среда или раствор являются электролитом, который приводит к образованию различных элементарных ячеек и возникновению электродов с разным потенциалом. Это приводит к развитию электрического тока и процессу электрохимической коррозии.
Одним из важных факторов, влияющих на электрохимическую коррозию, является разность потенциалов между металлом и раствором. Если разность потенциалов положительна, то металл выступает в роли анода и подвергается процессу коррозии. Если разность потенциалов отрицательна, то металл выступает в роли катода и не подвержен коррозии. Таким образом, электрохимическая коррозия зависит от совместного действия электрического тока и химических реакций, происходящих в растворе и на поверхности металла.
Что такое электрохимическая коррозия металлов?

Электрохимическая коррозия металлов - это процесс разрушения металла, вызванный взаимодействием его поверхности с окружающей средой. В отличие от химической коррозии, электрохимическая коррозия обусловлена протеканием электрохимических реакций на поверхности металла. Это происходит в результате разности потенциалов, образующейся между различными участками металла.
Вначале на поверхности металла образуется анодная область, где происходит окисление металла и выделение электронов. Создается разность потенциалов между анодной и катодной областями. Катодная область обеспечивает восстановление ионы, протекающие на поверхности металла.
Электрохимическая коррозия особенно активизируется в присутствии электролитов, таких как вода или соли. Вода или соли служат электролитами для проведения электролитических процессов и создания разности потенциалов между анодными и катодными областями металла.
Процесс коррозии может привести к понижению прочности и стабильности металла, а также к его деформации и разрушению. Поэтому контроль и предотвращение электрохимической коррозии является важной задачей в области материаловедения и инженерии.
Отличие электрохимической коррозии металлов от химической
Коррозия металлов - это процесс разрушения металлических материалов под воздействием окружающей среды. Однако существуют два основных типа коррозии: электрохимическая и химическая.
Основное отличие электрохимической коррозии от химической заключается в механизмах разрушения металла.
Электрохимическая коррозия происходит под влиянием электрического потенциала, сформированного на металлической поверхности. Под действием внешних факторов, таких как влага или соли, металлическая поверхность может выступать в роли анода или катода в реакции окисления и восстановления. В результате этого процесса металл постепенно разрушается.
С другой стороны, химическая коррозия происходит в результате прямого взаимодействия металла с определенными химическими веществами. Например, контакт с кислотами или щелочами может вызвать химическое разрушение металла без участия электрических потенциалов.
Важно отметить, что электрохимическая коррозия является наиболее распространенным и опасным типом коррозии, так как она может происходить даже при небольшой разности потенциалов на поверхности металла. Она может накапливаться и прогрессировать со временем, приводя к значительному разрушению и потере функциональности металлических конструкций.
В обоих случаях металлы должны быть защищены от коррозии с помощью различных методов и специальных защитных покрытий, которые помогут предотвратить разрушение металлических поверхностей.
Основные причины электрохимической коррозии металлов
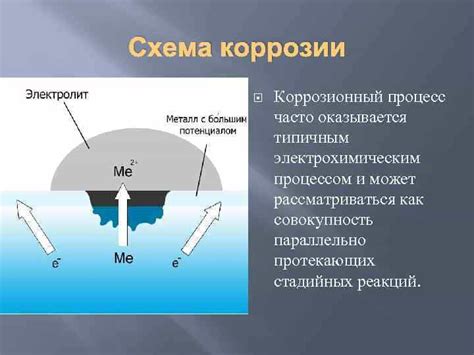
1. Возникновение гальванической пары: Электрохимическая коррозия металлов может возникать из-за контакта различных металлов в присутствии электролита. При таком контакте один металл становится анодом, а другой - катодом. На аноде проходят окислительные процессы, а на катоде - восстановительные. Эта разность потенциалов приводит к течению электрического тока и разрушению анода.
2. Наличие коррозионно-активных сред: Некоторые среды, такие как кислоты, соли и влага, могут быть коррозионно-активными и способствовать электрохимической реакции на поверхности металла. Взаимодействие этих веществ с металлом приводит к образованию оксидов, которые разрушают структуру металла.
3. Неравномерное распределение состава сплавов: Электрохимическая коррозия может возникать из-за неравномерного распределения состава сплавов. Различные компоненты сплава могут иметь различную электрохимическую активность, что приводит к образованию гальванической пары и разрушению металла.
4. Наличие дефектов на поверхности металла: Дефекты на поверхности металла, такие как царапины, трещины или грубости, могут служить основным местом образования коррозии. В этих местах можно наблюдать более интенсивные электрохимические процессы.
5. Воздействие токсичных веществ: Некоторые вещества, такие как сероводород или фториды, могут проникать в структуру металла и вызывать электрохимическую коррозию. Токсичные вещества изменяют равновесие между окислительными и восстановительными реакциями на поверхности металла и способствуют его разрушению.
6. Неравномерное распределение температуры: В процессе нагревания или охлаждения металла может возникнуть неравномерное распределение температуры, что приводит к появлению различных зон активного и пассивного поверхностного слоя. В таких условиях могут активироваться электрохимические процессы и происходить коррозия металла.
Влияние окружающей среды на электрохимическую коррозию металлов
Электрохимическая коррозия является одним из основных способов разрушения металлов под воздействием окружающей среды. Эта процесс неизбежно происходит в контакте металла с влажностью, кислотами или щелочами, что приводит к повреждению поверхности и снижению его механических свойств.
Влияние окружающей среды на электрохимическую коррозию металлов зависит от различных факторов. Одним из них является концентрация агрессивной среды. Чем выше концентрация кислот или щелочей, тем интенсивнее происходит процесс коррозии. Например, интенсивная коррозия железа происходит в кислотной среде, аллюминия – в кислотных и щелочных растворах.
Также важным фактором является температура окружающей среды. При повышенной температуре скорость электрохимической коррозии увеличивается. Особенно это касается железа и стали. Кроме того, некоторые металлы могут быть подвержены альтернативной коррозии, например, окислению при высоких температурах.
Наличие кислорода также существенно влияет на электрохимическую коррозию металлов. Воздушный кислород, находясь в соприкосновении с металлом, вызывает окисление его поверхности и создает благоприятные условия для коррозии.
Необходимо также учитывать наличие загрязнений и примесей в окружающей среде. Некоторые вещества могут ускорять процесс коррозии, например, хлориды или сернистый газ. Они проникают в металлическую структуру и инициируют дополнительные электрохимические процессы.
Таким образом, окружающая среда играет важную роль в электрохимической коррозии металлов. Различные факторы, такие как концентрация агрессивных веществ, температура, наличие кислорода и примесей, могут ускорять или замедлять этот процесс. Поэтому при выборе материала для конструкции необходимо учитывать условия эксплуатации и специфические требования среды, в которой будет находиться металл.
Методы предотвращения электрохимической коррозии металлов
Электрохимическая коррозия является одной из основных причин разрушения металлических конструкций и оборудования. Для предотвращения этого процесса существуют различные методы и технологии, которые позволяют защитить металлы от воздействия агрессивных сред и увеличить их срок службы.
Один из основных методов предотвращения электрохимической коррозии металлов - это применение защитных покрытий. Защитные покрытия создают физическую преграду между металлом и агрессивной средой, блокируя проникновение кислорода, воды и других веществ, которые могут вызвать коррозию.
Наиболее распространенными защитными покрытиями являются покрытия на основе эпоксидных или полиуретановых смол, гальванические покрытия, органические и неорганические покрытия, а также нанокомпозитные покрытия. Каждый вид покрытия имеет свои преимущества и ограничения.
Другой метод предотвращения электрохимической коррозии - это использование антикоррозионных покрытий. Антикоррозионные покрытия содержат компоненты, которые реагируют с металлом, образуя защитную пленку и предотвращая развитие коррозии. Такие покрытия обычно содержат растворимые соли металлов или специальные соединения, которые создают пассивную защитную пленку на поверхности металла.
Дополнительный способ предотвращения электрохимической коррозии - это использование анодной защиты. Анодная защита представляет собой метод, при котором на поверхности металла создается искусственный анод, который реагирует с агрессивной средой, уступая свои электроны. В результате этой реакции металл становится катодом и не подвержен коррозии.
Важным методом предотвращения электрохимической коррозии является использование коррозионно-стойких сплавов. Коррозионно-стойкие сплавы обладают высокой стойкостью к разрушению под воздействием агрессивных сред и могут использоваться в условиях, где обычные металлы быстро разрушаются. Эти сплавы содержат добавки, которые способствуют формированию защитной пленки или снижают активность агрессивной среды на металле.
В зависимости от условий эксплуатации и требований к металлической конструкции или оборудованию, можно применять один или несколько методов предотвращения электрохимической коррозии металлов. Это позволит сохранить металлические изделия в рабочем состоянии и продлить их срок службы.
Вопрос-ответ
Чем электрохимическая коррозия металлов отличается от химической коррозии?
Основное отличие между электрохимической и химической коррозией заключается в причине и механизме их возникновения. Электрохимическая коррозия является результатом взаимодействия металла с окружающей средой под влиянием электрических потенциалов. В то время как химическая коррозия происходит без участия электричества и вызывается прямыми химическими реакциями между металлом и окружающей средой.
Как происходит электрохимическая коррозия металлов?
Электрохимическая коррозия металлов происходит в результате переноса электронов между металлом и его окружающей средой. На поверхности металла образуются анодные и катодные области. В анодном месте металл распадается и окисляется, освобождая электроны. Эти электроны переносятся через электролит к катодной области, где восстанавливают металл. Таким образом, происходит неравномерное разрушение металла в результате постоянного цикла окисления и восстановления.
Какие факторы влияют на электрохимическую коррозию металлов?
На электрохимическую коррозию металлов могут влиять различные факторы, включая химический состав окружающей среды, температуру, влажность, наличие загрязнителей и другие. Например, наличие воды или солей может ускорить процесс коррозии, так как они увеличивают проводимость электролита и усиливают движение электронов.
Как можно предотвратить электрохимическую коррозию металлов?
Существует несколько методов предотвращения электрохимической коррозии металлов. Один из них - нанесение защитных покрытий на поверхность металла, таких как краски, лаки или покрытия из пластика или резины. Другой метод - использование специальных антикоррозионных материалов или добавок, которые могут уменьшить скорость реакции коррозии. Также возможно использование анодной защиты, которая заключается в подключении к металлу внешнего источника электрического тока, чтобы предотвратить его окисление.