Щелочные металлы являются первой группой периодической таблицы и включают элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Свое название они получили из-за своей способности образовывать щелочные растворы при взаимодействии с водой.
Электронное строение этих атомов наиболее устойчиво при заполнении внешнего энергетического уровня, обозначаемого как ns1, где n - номер энергетического уровня (главная квантовое число). Это означает, что на внешнем энергетическом уровне находится один электрон.
Например, в атоме лития (Li) имеется только два электрона, которые распределены на двух энергетических уровнях. Первый электрон на первом энергетическом уровне (K-оболочка), а второй электрон занимает внешний энергетический уровень (L-оболочка), обозначаемый как 2s1, где 2 - номер энергетического уровня, а s1 - обозначение подуровня s с одним электроном.
Такой электронный конфигурация атомов щелочных металлов позволяет им быть химически активными и легко образовывать ионный бонд с другими элементами. Данный факт определяет их уникальные свойства и широкое применение в различных отраслях промышленности и научных исследованиях.
Атомы щелочных металлов и их электронное строение
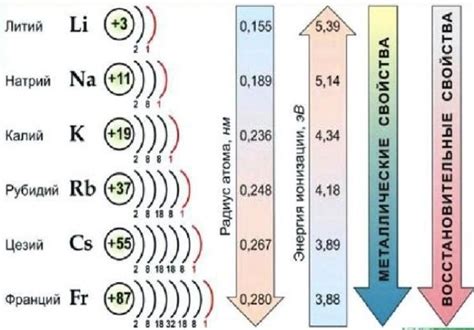
Щелочные металлы представляют собой группу элементов, состоящую из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Все они обладают сходными химическими свойствами, что можно объяснить их общим электронным строением внешнего энергетического уровня.
Электронное строение атомов щелочных металлов характеризуется наличием одного электрона во внешней s-подобной оболочке. Внешний энергетический уровень электронной конфигурации этих элементов обозначается как ns1, где n - номер главной энергетической оболочки (2 для лиги, 3 для натрия и т.д.).
Электрон, находящийся на внешнем энергетическом уровне, называется валентным электроном. Именно он определяет основные химические свойства щелочных металлов. Поскольку у атомов этих элементов только один валентный электрон, они имеют тенденцию легко отдавать этот электрон и образовывать положительные ионы.
Интересно отметить, что электронное строение атомов щелочных металлов позволяет им образовывать стабильные соединения с химическими элементами, чей электронный окостенок предполагает наличие одного или двух электронов, которые могут быть переданы щелочным металлам. Это делает их очень реакционноспособными и используется во многих технологических процессах и в химии в целом.
Что такое атомы щелочных металлов?
Атомы щелочных металлов являются элементами периодической таблицы, которые относятся к первой группе. В эту группу входят такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Атомы щелочных металлов имеют характерные особенности в своем электронном строении. Внешнее энергетическое уровень атомов щелочных металлов содержит всего один электрон, заполненный на s-орбитали. Это делает их очень реакционноспособными элементами, так как они стремятся отдать свой единственный электрон и образовать ион с положительным зарядом.
Также следует отметить, что атомы щелочных металлов обладают низкой электроотрицательностью, что означает, что они имеют большую способность отдавать свои электроны. Именно это свойство делает их отличными для использования в различных химических реакциях и применении в промышленности и технологиях.
Что такое электронное строение?

Электронное строение - это распределение электронов во внешнем энергетическом уровне атома. Оно определяет химические свойства элемента и его способность взаимодействовать с другими веществами.
Во внешнем энергетическом уровне атомов щелочных металлов ns1, где n - любое натуральное число, находится только один электрон. Это делает их очень реактивными элементами, так как они стремятся потерять этот одиночный электрон и образовать положительный ион.
Такое электронное строение обеспечивает устойчивую структуру вещества. Атом щелочных металлов стремится достигнуть электронной конфигурации инертного газа путем передачи излишнего электрона другому атому или молекуле. Это позволяет щелочным металлам образовывать ионы с постоянной положительной зарядом и облегчает их реакции с другими веществами.
В таблице Менделеева щелочные металлы расположены в первой группе (группе 1) и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти элементы имеют общую особенность - в их электронной оболочке находится всего один электрон на s-орбитале. Именно эта особенность обуславливает их уникальные свойства и широкое применение в различных областях науки и техники.
Внешний энергетический уровень атомов щелочных металлов
Внешний энергетический уровень атомов щелочных металлов представляет собой электронный уровень, на котором располагается единственный внешний электрон. Данный уровень имеет обозначение ns1, где n - главное квантовое число, а s - обозначение основного магнитного квантового числа. Щелочные металлы включают в себя элементы литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Все атомы щелочных металлов характеризуются наличием одного электрона на своем внешнем энергетическом уровне. Этот электрон находится в s-орбитали и обладает наименьшей энергией в атоме. Такое расположение электрона делает атомы щелочных металлов очень реакционноспособными и склонными к образованию положительных ионов.
Атомы щелочных металлов химически активны из-за того, что внешний энергетический уровень недостаточно заполнен электронами. Исходя из этого, они стремятся либо отдать внешний электрон и образовать положительный ион, либо присоединить еще один электрон и образовать отрицательный ион.
Одной из характеристик атомов щелочных металлов является малая энергия ионизации, что свидетельствует о легкости удаления внешнего электрона и образования положительного иона. Также, атомы щелочных металлов обладают низкой электроотрицательностью, что означает их склонность к присоединению дополнительного электрона и образованию отрицательного иона.
Электронное строение атомов щелочных металлов

Атомы щелочных металлов, таких как литий, натрий, калий и других, имеют конфигурацию электронных оболочек ns1, где n - номер энергетического уровня. Данный тип строения характеризуется наличием одного электрона в внешней s-подуровне, что делает щелочные металлы намного более активными химическими элементами.
Одним из характерных свойств щелочных металлов является их высокая реактивность, обусловленная наличием одного электрона в самой свободной энергетической оболочке. Этот электрон легко отделяется от атома, что приводит к образованию положительно заряженных ионов, способных образовывать сильные ионные связи с отрицательными ионами других элементов. Это обстоятельство также влияет на их высокую реактивность.
Данная особенность электронного строения атомов щелочных металлов также определяет их способность к образованию специфических химических соединений. Например, щелочные металлы легко прореагируют с водой, высвобождая водород и образуя гидроксиды. Они также способны образовывать соли со многими анинами, так как электрон образует ион с одним положительным зарядом.
Стоит отметить, что электронное строение атомов щелочных металлов также влияет на их физические свойства. Например, они обладают низкой температурой плавления и кипения, а также хорошей электропроводностью. Это объясняется легкостью движения одного электрона в внешней энергетической оболочке, который может свободно передвигаться по кристаллической решетке металла.
Принцип заполнения электронных оболочек атомов щелочных металлов
Атомы щелочных металлов, таких как литий, натрий, калий и другие, имеют особое электронное строение на своем внешнем энергетическом уровне. Внешний энергетический уровень содержит только одну электронную оболочку, обозначаемую как n и имеющую один электрон. Такая электронная конфигурация характерна для всех атомов щелочных металлов.
Принцип заполнения электронных оболочек атомов щелочных металлов следует общим правилам заполнения электронных оболочек. Правило заполнения электронных оболочек устанавливает, что электроны заполняют энергетические уровни последовательно, начиная с наименьшего энергетического уровня и двигаясь к наибольшему. Каждая электронная оболочка заполняется максимально допустимым количеством электронов.
Для атомов щелочных металлов с электронной конфигурацией ns1, на внешнем энергетическом уровне находится 1 электрон. Это означает, что в электронной оболочке n находится 1 электронный слой и на нем расположен 1 электрон. Такое строение оболочки делает атомы щелочных металлов химически активными и склонными к реакциям с другими элементами.
Принцип заполнения электронных оболочек атомов щелочных металлов имеет важное значение для объяснения и понимания их химических свойств и реакций. Зная электронную конфигурацию атома щелочного металла и его электронную оболочку, можно предсказать его химическое поведение и способность образовывать соединения с другими элементами. Это позволяет использовать щелочные металлы в различных промышленных и научных областях.
Некоторые особенности электронного строения атомов щелочных металлов

Электронное строение атомов щелочных металлов возникает на основе одноэлектронной конфигурации внешнего энергетического уровня, обозначаемого как ns1. Это означает, что на внешнем энергетическом уровне атома присутствует лишь один s-электрон, который является самым энергетически доступным электроном в системе.
Это свойство ставит атомы щелочных металлов в уникальное положение по сравнению с другими элементами периодической таблицы. Они характеризуются высокой реактивностью и способностью образовывать ионные связи с другими элементами за счет отдачи своего единственного электрона.
Благодаря этой реактивности, щелочные металлы являются отличными участниками химических реакций. Например, они легко реагируют с водой, выбивая из нее водород и образуя щелочные гидроксиды. Также, атомы щелочных металлов способны образовывать ионные связи с другими атомами, образуя кристаллические решетки, которые обладают характерной структурой и свойствами.
Выводящиеся электронные уровни атомов щелочных металлов также играют важную роль в оптических свойствах. Например, натрий обладает способностью поглощать и испускать видимый свет, что делает его полезным в роли источника света в различных приборах и системах.
Важность понимания электронного строения атомов щелочных металлов
Электронное строение атомов является фундаментальной характеристикой, определяющей свойства и химическую активность элементов. В особенности, важно понимать электронное строение атомов щелочных металлов, так как они являются одной из основных групп элементов в периодической системе.
Атомы щелочных металлов имеют электронную конфигурацию ns1, где n обозначает номер энергетического уровня атома. Это означает, что внешний энергетический уровень атома щелочного металла содержит всего один электрон. Такая простая электронная конфигурация делает атомы щелочных металлов очень реактивными.
Понимание электронного строения атомов щелочных металлов помогает объяснить их свойства, такие как низкая ионизационная энергия, высокая электроотрицательность и способность образовывать ионы положительной заряды. Например, низкая ионизационная энергия позволяет щелочным металлам легко отделять внешний электрон и образовывать положительные ионы.
Знание электронного строения атомов щелочных металлов также полезно при изучении их реакций с другими элементами. Например, щелочные металлы реагируют с водой, образуя щелочные растворы и выделяя водород. Это объясняется тем, что атомы щелочных металлов легко отдают свой внешний электрон, образуя ионы с положительным зарядом, которые реагируют с водой.
Вопрос-ответ
Что такое электронное строение внешнего энергетического уровня?
Электронное строение внешнего энергетического уровня атома определяется количеством электронов на этом уровне. Внешний энергетический уровень называется также валентным уровнем, и он играет важную роль в химических реакциях атома.
Чем отличается электронное строение внешнего энергетического уровня атомов щелочных металлов от других элементов?
Любые атомы, включая атомы щелочных металлов, стремятся достичь стабильного электронного строения. Внешний энергетический уровень атомов щелочных металлов состоит из одного s-электрона, что делает их очень реакционноспособными и склонными к образованию ионов с положительным зарядом.
Каково электронное строение внешнего энергетического уровня атомов щелочных металлов?
Электронное строение внешнего энергетического уровня атомов щелочных металлов характеризуется наличием одного s-электрона на этом уровне. Например, у лития на внешнем энергетическом уровне находится один s-электрон (1s^2s^1), у натрия - один s-электрон (1s^2s^2p^63s^1) и так далее.
Почему атомы щелочных металлов склонны к образованию ионов с положительным зарядом?
Атомы щелочных металлов имеют один валентный электрон на внешнем энергетическом уровне, и для достижения стабильного электронного строения им необходимо отдать или передать этот электрон. Таким образом, они образуют положительно заряженные ионы, у которых на внешнем энергетическом уровне нет электронов.
Как внешнее электронное строение атомов щелочных металлов влияет на их реакционноспособность?
Внешнее электронное строение атомов щелочных металлов делает их очень реакционноспособными. Их единственный валентный электрон легко участвует в химических реакциях, образуя положительно заряженные ионы. Они обладают большой способностью к образованию ионных связей и могут легко вступать в реакции с другими веществами.
