Щелочные металлы - это группа элементов, которые находятся в первой группе периодической системы. К этой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Химические свойства этих элементов, такие как высокая реактивность и низкая плотность, являются результатом их электронной конфигурации.
Электронная конфигурация атома щелочного металла определяется количеством электронов в его электронных оболочках. Основная электронная оболочка щелочных металлов содержит два электрона s-подуровня, а внешняя оболочка содержит один электрон s-подуровня. Такая конфигурация обуславливает химическую активность этих элементов. Они стремятся отдать этот один электрон, чтобы стать ионами с положительным зарядом.
Изменение электронной конфигурации атома щелочных металлов может происходить под воздействием внешних условий, таких как высокая температура или наличие других химических элементов. Например, при взаимодействии с водой, атомы щелочных металлов могут отдавать свой внешний электрон, образуя ионы с положительным зарядом, которые образуют раствор с щелочной реакцией.
Интересно, что электронная конфигурация атома щелочных металлов также играет важную роль во многих других процессах, таких как использование этих элементов в батареях, фотоэлементах и других электротехнических устройствах.
В заключение, электронная конфигурация атома щелочного металла является ключевым фактором, определяющим его химические свойства и реактивность. Взаимодействие этих элементов с другими химическими веществами основывается на их способности отдавать внешний электрон и образовывать ионы с положительным зарядом. Изучение электронной конфигурации щелочных металлов позволяет лучше понять их химические свойства и использование в различных областях науки и технологии.
Что такое электронная конфигурация атома?

Электронная конфигурация атома отражает распределение электронов по энергетическим уровням и подуровням внутри атома. Она описывает, сколько электронов находится на каждом энергетическом уровне и какие подуровни заполнены электронами.
Атом состоит из ядра и окружающей его оболочки электронов. Электроны находятся на разных энергетических уровнях - от наиболее близких к ядру, имеющих более низкую энергию, до наиболее удаленных, имеющих более высокую энергию.
Энергетические уровни обозначаются числами 1, 2, 3 и т.д., а подуровни - буквами s, p, d, f и т.д. Уровень с буквой s может содержать до 2 электронов, уровень с буквой p - до 6 электронов, уровень с буквой d - до 10 электронов, а уровень с буквой f - до 14 электронов.
Электронная конфигурация атома щелочного металла, таких как литий, натрий или калий, может быть представлена следующим образом:
- Литий (Li): 1s2 2s1
- Натрий (Na): 1s2 2s2 2p6 3s1
- Калий (K): 1s2 2s2 2p6 3s2 3p6 4s1
В электронной конфигурации указывается каждый уровень и подуровень, а также количество электронов, находящихся на них. Например, электронная конфигурация лития показывает, что в первом энергетическом уровне (1s) находятся 2 электрона, а во втором энергетическом уровне (2s) - 1 электрон.
Знание электронной конфигурации атома важно для понимания его химических свойств и поведения в реакциях. Она определяет расположение электронов в атоме и влияет на его реакционную способность и возможность образования связей с другими атомами.
Чем отличается электронная конфигурация атома щелочного металла?
Электронная конфигурация атома щелочного металла отличается от конфигурации атомов других элементов благодаря особенностям их внешней электронной оболочки. Щелочные металлы - это элементы первой группы таблицы Менделеева, включающие литий, натрий, калий, рубидий, цезий и франций.
Особенностью электронной конфигурации атомов щелочных металлов является то, что в их внешней электронной оболочке всегда находится один электрон. Это делает их очень реакционными и легко образующими положительный ион. Этот электрон сравнительно легко может отойти от атома, образуя ион с положительным зарядом.
С другой стороны, электронная конфигурация атомов щелочных металлов создает у них свойство образования ионов с отрицательным зарядом. Это связано с тем, что атомы щелочных металлов имеют только один электрон в внешней оболочке, и они могут достичь стабильности за счет приобретения одного или нескольких электронов. Таким образом, они могут образовывать отрицательно заряженные ионы.
Все эти особенности электронной конфигурации атомов щелочных металлов определяют их химическую активность и реакционность. Они с легкостью вступают в химические реакции, образуя стабильные соединения с другими элементами, и широко используются в различных областях науки и промышленности.
Особенности электронных оболочек щелочных металлов

Щелочные металлы – это элементы, которые находятся в первой группе периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Особенностью этих металлов является то, что их электронные оболочки имеют всего один электрон в внешней оболочке. Это делает их очень реактивными и обладающими химическими свойствами, которые отличаются от других элементов.
Наличие только одного электрона в внешней оболочке щелочных металлов делает их очень нестабильными и склонными к реакциям с другими веществами. Они имеют тенденцию потерять этот электрон и образовать положительный ион. Это объясняет их большую реактивность, особенно в присутствии веществ с высокой электроотрицательностью, такими как кислород или хлор.
Электронные оболочки щелочных металлов также определяют их физические свойства. Например, они обладают малой атомной радиусом и низкой плотностью, что делает их мягкими и легкими металлами. Их плотность и мягкость увеличиваются с увеличением атомного номера, что объясняется наличием большего количества электронов и притяжением ядра к электронам.
Также следует отметить, что щелочные металлы имеют низкую температуру плавления и кипения. Это связано с их структурой, где атомы щелочных металлов связаны слабой металлической связью. Это позволяет им легко переходить из твердого состояния в жидкое и газообразное состояния при относительно низких температурах.
В целом, электронные оболочки щелочных металлов играют ключевую роль в определении их химических и физических свойств. Одноэлектронная внешняя оболочка делает их реактивными и помогает им образовывать стабильные соединения с другими элементами.
Как определить электронную конфигурацию атома щелочного металла?
Щелочные металлы - это элементы первой группы периодической системы, включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы характеризуются сильной реакционностью и низкой ионизационной энергией, что делает их атомы стабильными в основном состоянии. Определение электронной конфигурации атома щелочного металла является важной задачей в изучении их химических свойств.
Для определения электронной конфигурации атома щелочного металла можно использовать следующий алгоритм:
- Определите количество электронов в атоме ионе щелочного металла. Это равно порядковому номеру атома в периодической системе.
- Заполните электронные оболочки атома, начиная с первой оболочки и двигаясь вперед.
- Перемещайтесь по периодической системе слева направо и сверху вниз, заполняя электроны по отдельным подоболочкам: 1s, 2s, 2p, 3s и т.д.
- Запишите электронную конфигурацию атома, используя общепринятую запись, например: 1s2 2s2 2p6 3s1 для лития (Li).
Таблица периодической системы химических элементов также может помочь в определении электронной конфигурации атома щелочного металла. В этой таблице приведена информация о порядковых номерах элементов, их символах и электронной конфигурации.
Знание электронной конфигурации атома щелочных металлов позволяет понять, какие оболочки электронов заняты, и, следовательно, предсказать их химическое поведение. Это важный шаг в изучении химических реакций и свойств этих элементов.
Электронная конфигурация атома лития
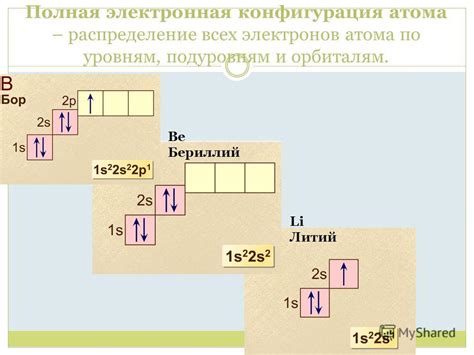
Литий (Li) - это щелочной металл, химический элемент из первой группы периодической таблицы. Его атомный номер равен 3. Атом лития имеет электронную конфигурацию 1s^2 2s^1.
Атомный номер определяет количество электронов в атоме каждого элемента. В электронной конфигурации атома лития первые два электрона заполняют внутреннюю оболочку - 1s. Оставшийся третий электрон находится на внешней оболочке - 2s. В этом электронном распределении первое число (1) указывает на номер главной оболочки (энергетического уровня), а второе число (s) указывает на форму подуровня, на котором находится электрон.
Атом лития имеет один свободный электрон на внешней оболочке, что делает его очень реактивным. Литий активно реагирует с кислородом, образуя оксид лития, и с водой, выделяясь водородом. Из-за своей низкой плотности, литий отличается от других металлов и используется в различных промышленных и научных приложениях.
Таблица элементов позволяет легко определить электронную конфигурацию атома лития и других элементов. Она показывает, как электроны заполняют энергетические уровни и подуровни в атомах и может быть полезным инструментом при изучении химических свойств различных элементов.
Электронная конфигурация атома натрия
Электронная конфигурация атома натрия можно представить следующим образом:
- 1s2 - два электрона в s-подуровне первой энергетической оболочки.
- 2s2 - два электрона в s-подуровне второй энергетической оболочки.
- 2p6 - шесть электронов в p-подуровне второй энергетической оболочки.
- 3s1 - один электрон в s-подуровне третьей энергетической оболочки.
Таким образом, атом натрия имеет общую электронную конфигурацию 1s2 2s2 2p6 3s1. Это означает, что в его внешней энергетической оболочке находится один электрон, который легко может участвовать в химических реакциях.
Натрий является щелочным металлом и относится к первой группе периодической системы элементов. Этот элемент характеризуется высокой реактивностью из-за наличия одного электрона во внешней оболочке, который может легко отдавать.
Электронная конфигурация атома натрия объясняет его способность образовывать ион с положительным зарядом Na+. При этом, нарушается электронная нейтральность атома, так как он теряет внешний электрон и превращается в катион.
Натрий широко используется в промышленности и бытовой сфере. Он является важным компонентом соли, добавляется в пищу в виде поваренной или пищевой соли. Также, натрий применяется в производстве стекла, пластиков и многих других продуктов. Его способность образовывать ионы находит применение в химической промышленности и в производстве электрических аккумуляторов.
Электронная конфигурация атома калия
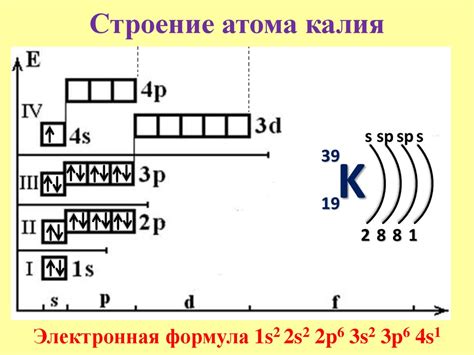
Калий (K) - это щелочной металл, который имеет атомный номер 19 в периодической системе элементов. Его электронная конфигурация может быть представлена как 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹.
Внешний электронный слой атома калия представлен только одним электроном в 4s орбитали. Этот электрон находится на самом большом энергетическом уровне и является валентным электроном.
Электронный конфигурация атома калия может быть представлена также с помощью сокращенной записи: [Ar] 4s¹. Сокращенная запись использует символ аргона ([Ar]), чтобы обозначить подобные энергетические уровни, которые были заполнены перед 4s орбиталью.
Атомы калия имеют тенденцию потерять один электрон из 4s орбитали, чтобы достичь устойчивой конфигурации эдельгейня. Это позволяет атому калия образовывать катионы K⁺, которые обладают положительным зарядом.
Значение электронной конфигурации щелочных металлов
Щелочные металлы - группа элементов периодической системы, состоящая из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). У этих элементов одна общая характеристика - они легко отдают свой внешний электрон и образуют положительные ионы.
Электронная конфигурация щелочных металлов основана на расположении электронов в энергетических уровнях атома. У всех щелочных металлов внешний электрон находится в s-орбитали последнего энергетического уровня. Например, электронная конфигурация калия (K) - [Ar] 4s1, где [Ar] обозначает полную заполненность предыдущего энергетического уровня.
Значение электронной конфигурации щелочных металлов определяет их химические свойства. Благодаря наличию одного внешнего электрона, щелочные металлы хорошо реагируют с другими веществами, особенно с неметаллами. Они образуют ионы с положительным зарядом, легко становятся окислителями и способны образовывать стабильные соединения.
Также, электронная конфигурация определяет физические свойства щелочных металлов. Например, они обладают низкой плотностью и температурой плавления, что делает их мягкими и легкообрабатываемыми. Кроме того, электронная конфигурация влияет на показатели химической реактивности и электропроводности щелочных металлов.
Вопрос-ответ
Какую электронную конфигурацию имеет атом щелочного металла?
Атом щелочного металла имеет электронную конфигурацию ns1, где n - номер оболочки и s - подоболочка s-типа.
Почему атом щелочного металла имеет электронную конфигурацию ns1?
Атом щелочного металла имеет электронную конфигурацию ns1, потому что в своей внешней оболочке у него находится только один электрон, который хочет уйти и стать ионом положительного заряда.
Почему атом щелочного металла имеет только один электрон во внешней оболочке?
Атом щелочного металла имеет только один электрон во внешней оболочке, потому что число электронов в ней равно номеру периода, а щелочные металлы находятся на первом периоде, где всего одна оболочка.
