Электронная конфигурация атома описывает распределение электронов по энергетическим уровням и подуровням. В данной статье мы рассмотрим особенности электронной конфигурации атомов элементов с электронной конфигурацией 3d6 4s2 и сравним их с атомами аргона, железа, криптона и рутения.
Атом с электронной конфигурацией 3d6 4s2 состоит из 26 электронов. Первые 18 электронов находятся в энергетических уровнях и подуровнях, аналогичных атомному газу аргону. Оставшиеся 8 электронов распределены на энергетических уровнях 3d и 4s.
Сходство с атомом аргона заключается в том, что оба атома имеют полностью заполненную энергетическую оболочку (K, L, M), что делает их стабильными и малохимически активными. Благодаря этому сходству атомы с электронной конфигурацией 3d6 4s2 могут быть использованы в различных инженерных и технических решениях.
Кроме сходства с аргоном, атомы с электронной конфигурацией 3d6 4s2 также имеют сходства с атомами железа, криптона и рутения. Сходство с железом обусловлено наличием однозарядного ионного металла на внешнем энергетическом уровне, что позволяет атомам с электронной конфигурацией 3d6 4s2 образовывать стабильные соединения с другими элементами.
Сходство с криптоном проявляется в возможности образования слабой димерной связи между атомами с электронной конфигурацией 3d6 4s2, что является важным фактором для определенных химических реакций. И, наконец, сходство с рутением связано с наличием атомов с электронной конфигурацией 3d6 4s2 в d-блоке периодической системы элементов, что делает их похожими по химическим свойствам.
Электронная конфигурация 3d64s2 и ее сходство с аргоном
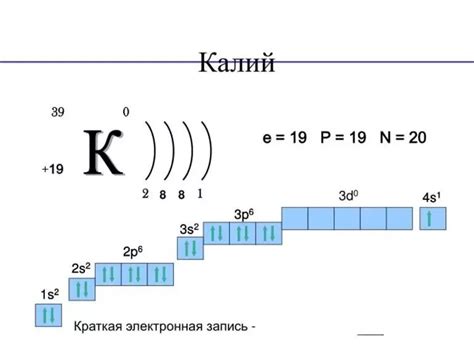
Электронная конфигурация атома с номером 26 – железа – в основном состоянии (3d64s2) имеет много общего с конфигурацией аргона. Оба элемента обладают полностью заполненной p-подобной оболочкой. У аргона и железа на этой оболочке находятся по шесть электронов.
Такое сходство объясняется тем, что атом железа имеет полностью заполненную 3d-оболочку (10 электронов) и два электрона на 4s-оболочке. Эти свободные электроны на 4s-оболочке стимулируют реактивность и химические свойства железа, но при этом атом железа стремится к заполнению 3d-оболочки до максимального значения.
Сходства электронной конфигурации 3d64s2 атома железа с конфигурациями аргона, криптона и рутения связаны с общей химической группой – переходными металлами. У всех этих элементов имеется 3d-оболочка, которая может содержать до 10 электронов, и 4s-оболочка с двумя электронами. Все эти элементы обладают разнообразными химическими свойствами и широким спектром возможных соединений.
Присутствие полностью заполненной p-подобной оболочки у аргона и сходства конфигурации 3d64s2 атома железа позволяют им быть относительно инертными в химических реакциях. Это объясняет низкую реактивность аргона и устойчивость железа. Однако благодаря наличию свободных электронов на 4s-оболочке, железо все же проявляет химическую активность, особенно при взаимодействии с окружающей средой.
Электронная конфигурация 3d64s2 и ее сходство с железом, криптоном и рутением
Электронная конфигурация 3d64s2 представляет собой последовательность заполнения электронных оболочек атомов определенного элемента. В данной конфигурации присутствуют электроны в оболочках 3d, 4s и 2s. Эта конфигурация имеет сходство с электронными конфигурациями железа, криптона и рутения.
Железо имеет электронную конфигурацию 3d64s2, что делает его близким аналогом атомов с электронной конфигурацией 3d64s2. Оба элемента имеют одинаковое число электронов в каждой оболочке, что делает их электронные структуры схожими. Это позволяет обнаружить сходство в химических свойствах и реакционной способности данных элементов.
Также сходство можно обнаружить между электронной конфигурацией 3d64s2 и электронными конфигурациями криптона и рутения. Криптон имеет электронную конфигурацию [Kr]5s24d105p6, где оболочка d заполнена полностью. Сходство здесь заключается в наличии электронов в оболочках 5s и 4s, что делает электронную структуру данных элементов схожей.
Рутений также имеет схожую электронную конфигурацию с 3d64s2, а именно 4d75s2. В данном случае оболочка 4d заполнена полностью, а оболочка 5s содержит два электрона. Такое сходство в электронных структурах делает рутений и элементы с электронной конфигурацией 3d64s2 схожими в химическом поведении и реакционной способности.
Выводя итог, электронная конфигурация 3d64s2 имеет сходство с железом, криптоном и рутением в расположении электронов во внешних оболочках. Это сходство определяет химическое поведение и реакционную способность данных элементов.
Вопрос-ответ
Какая электронная конфигурация у атома сходная с электронной конфигурацией 3d64s2?
Электронная конфигурация, сходная с 3d64s2, у атома криптона.
Чему равна электронная конфигурация атмоа аргона?
Электронная конфигурация аргона: 1s2 2s2 2p6 3s2 3p6.
Что имеется в виду под электронной конфигурацией атома железа?
Электронная конфигурация железа: 1s2 2s2 2p6 3s2 3p6 4s2 3d6.
Какая электронная конфигурация имеется у атома рутения?
Электронная конфигурация атома рутения: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d6.
Какая электронная конфигурация схожа с электронной конфигурацией 3d64s2?
Схожая электронная конфигурация имеется у атома криптона: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6.
Что общего у электронной конфигурации 3d64s2 и криптона?
Общее у электронной конфигурации 3d64s2 и криптона - наличие заполненной внешней энергетической оболочки без возможности образования дополнительных связей.
Какие элементы имеют сходство с электронной конфигурацией 3d64s2?
С электронной конфигурацией 3d64s2 сходны атомы аргона, железа, криптона и рутения.

