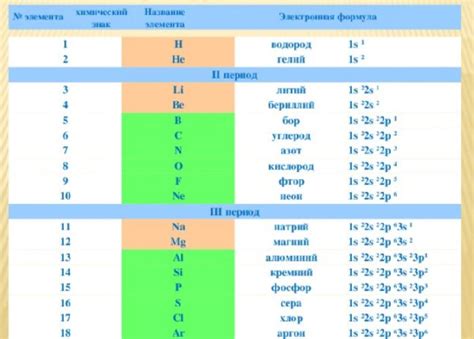
Электронная формула – это запись электронной конфигурации атомов или ионов в виде серии чисел и символов, которая представляет расположение электронов в энергетических оболочках. Она позволяет определить количество электронов на каждой оболочке исходного атома или иона.
Однако, для двухзарядного катиона металла такая электронная формула может быть затруднительной. Двухзарядный катион означает, что ион имеет двоякую положительную зарядность и, соответственно, вместо обычной электронной конфигурации, его электронную формулу следует записывать с учетом потери двух электронов.
Например, если рассматривается ион железа Fe^2+, то электронная формула будет выглядеть следующим образом: 1s^22s^22p^63s^23p^64s^23d^6, где предыдущие 18 электронов относятся к нейтральному атому железа, а оставшиеся 2 электрона – потерянные электроны, обусловленные положительной зарядностью иона.
Таким образом, электронная формула для двухзарядного катиона металла возможна и позволяет увидеть изменения в электронной конфигурации, обусловленные передачей электронов и получением положительного заряда.
Электронная формула двухзарядного катиона металла: возможна ли?

Электронная формула используется для обозначения распределения электронов в атоме или ионе в зависимости от их энергетических уровней. Однако, возможно ли составить электронную формулу для двухзарядного катиона металла?
Двухзарядный катион металла образуется, когда атом металла теряет два электрона и становится положительно заряженным. Это означает, что электронная формула такого катиона будет отражать отсутствие двух электронов на соответствующих энергетических уровнях.
Изначально атом металла имеет определенное количество электронов, связанных с его ядром. Обычно электроны заполняют энергетические уровни по правилу восеми электронов на внешнем энергетическом уровне. Однако, когда атом металла теряет два электрона и формирует двухзарядный катион, электронная формула будет показывать, что на последнем энергетическом уровне отсутствуют два электрона.
Таким образом, хотя электронная формула для двухзарядного катиона металла может быть записана с использованием символа "+2" для указания заряда, она не будет отражать точное количество электронов на каждом энергетическом уровне. Вместо этого, электронная формула указывает на наличие двух отсутствующих электронов на последнем энергетическом уровне.
Свойства и особенности двухзарядных катионов
Двухзарядные катионы металлов представляют собой ионы, которым присущи определенные свойства и особенности.
Во-первых, двухзарядные катионы имеют большее количество электронов, чем однозарядные катионы, что делает их более электроотрицательными. Это означает, что они проявляют большую способность принимать электроны и участвовать в химических реакциях.
Во-вторых, двухзарядные катионы обладают большим магнитным моментом, что связано с наличием дополнительных электронов. Это свойство позволяет им проявлять магнитные свойства и влиять на магнитные свойства соединений, в которых они участвуют.
Также стоит отметить, что двухзарядные катионы металлов обычно образуют стабильные соединения с отрицательно заряженными анионами, такими как атомы кислорода или серы. Это связано с тем, что двухзарядные катионы имеют более высокий заряд, который компенсируется зарядами анионов.
И наконец, двухзарядные катионы обладают высокой реакционной способностью и часто образуют стойкие соединения с различными веществами. Благодаря этому они широко используются в химической промышленности и в различных технических процессах.
Традиционный подход к обозначению электронной формулы
Электронная формула является графическим изображением распределения электронов в атоме или ионе. Традиционно электронная формула записывается в виде символов химических элементов, индексов и знаков, отражающих количество и расположение электронов.
Для двухзарядного катиона металла в традиционном подходе к обозначению электронной формулы используются различные правила. В основе этого подхода лежит использование схемы, называемой принципом заполнения электронных подуров.
Символьное обозначение элемента с указанием его порядкового номера в таблице Менделеева используется для обозначения первых двух электронов катиона. Затем, согласно принципу заполнения, пишутся такие символы, которые показывают последующие электроны в порядке возрастания энергии.
Для обозначения электронных подуров в традиционном подходе используются буквы s, p, d и f. Например, электронная формула для двухзарядного катиона металла меди (Cu2+) может быть записана как [Ar] 3d10 4s0.
Традиционный подход к обозначению электронной формулы позволяет удобно представить распределение электронов в атоме или ионе. Однако, современный подход использует более сложные модели и методы для изучения электронной структуры металлов и их катионов.
Современные разработки в области обозначения электронной формулы
Электронная формула является важным инструментом в химической нотации, позволяющим представить количество электронов в атоме или ионе. Она помогает установить связи между атомами и ионами в соединениях и определить их химические свойства. Однако, возникает вопрос – возможно ли создать электронную формулу для двухзарядного катиона металла?
Современные разработки в области обозначения электронной формулы позволяют представить двухзарядные катионы металла с помощью специальных обозначений. Так, для обозначения катиона металла с двумя положительными зарядами используются римские цифры в круглых скобках после обозначения металла. Например, для обозначения двухзарядного катиона железа используется Fe(II).
Это обозначение не только указывает на количество положительных зарядов, но и подразумевает наличие соответствующего количества электронов в электронной оболочке катиона. Таким образом, электронная формула Fe(II) позволяет представить структуру и свойства двухзарядного катиона железа.
Следует отметить, что электронная формула для двухзарядного катиона металла может быть представлена и более сложным образом, с использованием дополнительных символов и чисел. Например, для обозначения двухзарядного катиона алюминия используется Al3+. Здесь цифра "3" указывает на количество положительных зарядов и соответствующее количество электронов в электронной оболочке катиона.
Перспективы развития электронной формулы для двухзарядных катионов металла
Электронная формула является одним из основных инструментов химического анализа и позволяет описать структуру и состав соединений. Однако, существующие электронные формулы не всегда учитывают двухзарядные катионы металла, что ограничивает их применение в практике.
Одной из перспектив развития электронной формулы для двухзарядных катионов металла может быть создание расширенных таблиц Менделеева, в которых будет учтена информация о различных зарядах металла. Такие таблицы позволят более точно определить электронную формулу соединения, учитывая его структуру и заряды металла.
Другой перспективой может быть разработка программных комплексов, которые смогут автоматически определять электронную формулу для двухзарядных катионов металла на основе экспериментальных данных и математических алгоритмов. Применение таких комплексов значительно упростит и ускорит работу химиков и исследователей в области химии и материаловедения.
Также, возможным направлением развития электронной формулы для двухзарядных катионов металла является использование методов компьютерного моделирования. С помощью таких методов можно создать трехмерные модели соединений с учетом их структуры и зарядов металла, что позволит получить более точные результаты и прогнозировать свойства соединений на основе электронной формулы.
В целом, развитие электронной формулы для двухзарядных катионов металла представляет большой научный и практический интерес. Это позволит расширить область применения электронных формул и повысить точность представления соединений, что в свою очередь будет способствовать развитию химической индустрии и научных исследований в области материаловедения и химии.
Вопрос-ответ
Можно ли записать электронную формулу для двухзарядного катиона металла в общем виде?
Да, можно. Электронная формула для двухзарядного катиона металла имеет общий вид: [металл]^(2+).
Какие элементы образуют двухзарядные катионы?
Двухзарядные катионы могут образовываться различными элементами, например, ионами железа (Fe^2+), ионами меди (Cu^2+), ионами свинца (Pb^2+) и др.
Какие электронные оболочки участвуют в образовании двухзарядных катионов?
Образование двухзарядных катионов связано с потерей двух электронов из последней заполненной электронной оболочки. Например, ионы железа (Fe^2+) теряют два электрона из 3d-подуровня, а ионы свинца (Pb^2+) – из 6s-подуровня.
Что происходит со структурой атома при образовании двухзарядного катиона?
При образовании двухзарядного катиона происходит потеря двух электронов, что приводит к изменению заряда атома и его структуры. Катион становится недостаточно заряженным, и его электронная оболочка не заполняется полностью.
Как записать электронную формулу для конкретного двухзарядного катиона, например, для иона железа (Fe^2+)?
Электронная формула для иона железа (Fe^2+) будет выглядеть следующим образом: [Fe] = 1s^2 2s^2 2p^6 3s^2 3p^6 3d^6.
Можно ли определить заряд катиона по его электронной формуле?
Да, заряд катиона можно определить по его электронной формуле. Для этого необходимо вычесть число потерянных электронов из общего числа электронов в атоме. Например, для иона железа (Fe^2+) имеем: общее число электронов = 26, потерянные электроны = 2, заряд катиона = 26 - 2 = 24.

