Оксид меди(I), также известный как Cu2O или оксид медного(I), является составным оксидом, образующимся при взаимодействии меди с кислородом. Этот оксид обладает уникальными свойствами, которые делают его интересным для исследования и использования в различных областях.
Одной из главных особенностей Cu2O является его полупроводниковая природа. Этот оксид обладает широкой запрещенной зоной, что позволяет ему обладать как проводящими, так и изоляционными свойствами. Это делает Cu2O очень привлекательным для применения в электронике и солнечных батареях.
Кроме того, Cu2O обладает высокой устойчивостью к окислению, что позволяет ему использоваться в качестве покрытия для защиты других материалов от коррозии. Этот оксид также обладает высокой проводимостью, что позволяет использовать его в электролитических процессах и при производстве электрических контактов.
Важно отметить, что Cu2O обладает также интересными оптическими свойствами. Он является полупрозрачным материалом, способным поглощать и излучать свет. Это делает его полезным в приборах и приложениях, связанных с оптикой и фотоникой.
Историческая справка и общая информация

Оксид меди(I) (Cu2O) является одним из основных оксидов меди и широко известен своими уникальными свойствами и приложениями. Этот оксид металла был известен еще в древние времена и использовался в различных отраслях науки и промышленности.
В химии оксид меди(I) получают путем окисления меди (Cu) в присутствии кислорода. Он представляет собой кубическую кристаллическую структуру и обладает красным или красно-коричневым цветом. Cu2O обладает очень низкими электропроводностью и является полупроводником. Он имеет слабую связь и поэтому легко распадается на металлическую медь и кислород.
Из-за своей уникальной структуры и свойств Cu2O нашел широкое применение в различных отраслях промышленности. Он используется в солнечных батареях, так как обладает способностью преобразовывать солнечную энергию в электрическую. Также Cu2O используется в производстве красителей, электроники и катализаторов.
Оксид меди(I) является важным исследовательским объектом в химии, физике и электронике из-за своей уникальной структуры и химических свойств. Он продолжает привлекать внимание ученых и специалистов, которые стремятся раскрыть его потенциал и найти новые способы использования. Исследования и разработки в этой области продолжаются и представляют большой интерес для науки и промышленности.
Физические свойства Cu2O
Цвет: Кристаллы оксида меди (I) имеют красный или коричневый цвет.
Плотность: Оксид меди (I) обладает плотностью около 6 г/см³. Это высокое значение объясняется его кристаллической структурой.
Твердость: Cu2O имеет твердость 3,5-4 по шкале Мооса. Это достаточно мягкое вещество, которое можно резать и искривлять при небольшом давлении.
Точка плавления: Оксид меди (I) плавится при температуре около 1235°C. При нагревании Cu2O медленно превращается в CuO.
Растворимость: Cu2O плохо растворяется в воде, но может растворяться в кислых растворах и растворителях, таких как гидроксид натрия или аммиак.
Проводимость: Кристаллический оксид меди (I) обладает полупроводниковыми свойствами. Он имеет широкую запрещенную зону энергии, что делает его несколько проводящим, но не в полной мере проводящим.
Устойчивая кристаллическая структура
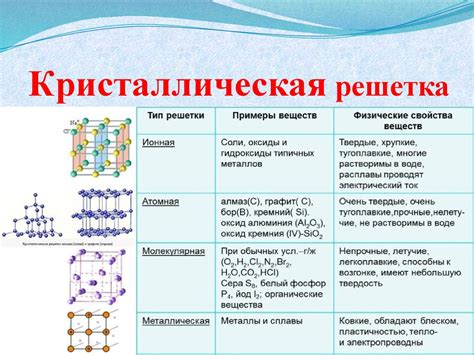
Cu2O обладает устойчивой кристаллической структурой, которая определяет его свойства. В основном, Cu2O имеет кубическую кристаллическую сетку, которая состоит из атомов меди и кислорода.
Структура Cu2O может быть представлена в виде кубической решетки, в которой атомы меди занимают угловые и центральные позиции, а атомы кислорода располагаются между ними. Такая упаковка атомов обеспечивает устойчивость кристаллической структуры и способствует формированию высоких температурных стабильных кристаллов.
Кристаллическая структура Cu2O также определяет его оптические свойства. Из-за особенностей кристаллической решетки, Cu2O обладает полупроводниковыми свойствами и имеет широкий запрещенный зон.
Такая устойчивая кристаллическая структура позволяет Cu2O использовать в различных областях, таких как электроника, солнечные батареи, катализ и фотокаталитические реакции.
Цвет и оптические свойства
Цвет Cu2O является одной из наиболее примечательных оптических особенностей этого оксида. Несмотря на то, что данное соединение обладает частично прозрачной структурой, его основной цвет варьируется от красного до красно-коричневого оттенка.
Основной цвет Cu2O обусловлен оптическими свойствами вещества и его электронной структурой. В молекулах Cu2O присутствуют поглощающие уровни, которые обеспечивают возможность поглощения света определенных длин волн.
Этот оксид обладает полупроводниковыми свойствами, что также отражается на его оптических свойствах. Cu2O имеет запрещенную зону, в которой отсутствуют свободные электроны или доступные энергетические уровни для поглощения фотонов с различными энергиями.
Важно отметить, что оптические свойства Cu2O имеют практическое применение в различных областях, включая фотокаталитическую активность, солнечные элементы и электрохимическую синтез.
Химические свойства Cu2O

Цвет и структура: Cu2O является красным кристаллическим соединением. Он образует кубическую решетку с плотноупакованными атомами.
Растворимость: Cu2O плохо растворяется в большинстве растворителей. Он не растворим в воде, но может растворяться в одних кислотах и алкалиях.
Окислительные свойства: Cu2O обладает окислительными свойствами, взаимодействуя с некоторыми веществами и окисляя их. Например, он может окисляться до CuO в присутствии кислорода из воздуха.
Восстановительные свойства: Cu2O также обладает восстановительными свойствами, способностью передавать электроны другим веществам. Он может восстановить некоторые окислители, такие как нитраты и пероксиды.
Реакция с кислотами: Cu2O реагирует с кислотами, образуя соответствующие соли и выделяя газ. Например, соляная кислота приводит к образованию соли меди и выделению хлороводорода.
Термохимическая устойчивость: Cu2O обладает высокой термохимической устойчивостью. Он обычно не разлагается при нормальных условиях температуры и давления, но при нагревании он может деградировать и образовывать другие соединения, такие как медь и CuO.
Амфотерные свойства: Cu2O обладает амфотерными свойствами, что означает его способность реагировать как с кислотами, так и с щелочами. Он может образовывать соли и гидроксиды меди с разными кислотами и щелочами.
Восстановительные свойства
Cu2O проявляет сильные восстановительные свойства. Он способен восстанавливать многие вещества, включая металлы и оксиды.
Восстановительные свойства Cu2O проявляются благодаря наличию в его структуре одноосных кристаллических дефектов, которые увеличивают подвижность электронов и способствуют процессам восстановления.
Кроме того, Cu2O может служить восстановителем в электрохимических реакциях. Он может реагировать соединениями, содержащими металлы в более высокой степени окисления, переходя сам в состояние оксида металла.
Восстановительные свойства Cu2O находят применение в различных областях, например, в электротехнике и электрохимии. Он используется в качестве активного компонента в солнечных батареях, поскольку способен преобразовывать солнечную энергию в электрическую.
Также Cu2O может быть использован в качестве катализатора в химических реакциях, где он способен ускорять процесс восстановления и снижать температуру реакции.
Окислительные свойства Cu2O
Окислительное свойство – это способность вещества выступать в реакциях как окислитель, то есть получать электроны от других веществ. Молекула оксида меди(I) (Cu2O) обладает такими свойствами.
В реакциях с окисляемыми веществами, Cu2O выступает в роли окислителя. Он способен принять два электрона и превратиться в ион меди(II) (Cu2+). Например, при реакции с металлом цинком (Zn), Cu2O окисляется, а цинк восстанавливается:
- 2 Cu2O + Zn → 2 Cu + ZnO
Оксид меди(I) также может служить окислителем в реакциях с некоторыми органическими соединениями. Например, при взаимодействии с альдегидами, Cu2O принимает два электрона и превращается в медь металлическую (Cu) и кислоту (R-COOH):
- 2 Cu2O + RCHO → 4 Cu + RCOOH
Также Cu2O может вступать в реакции с некоторыми сульфидами и нитратами, демонстрируя свои окислительные свойства. Например, при реакции с сероводородом (H2S), Cu2O окисляется и образуется сульфид меди(II) (CuS):
- Cu2O + H2S → CuS + H2O
Таким образом, оксид меди(I) (Cu2O) проявляет окислительные свойства во взаимодействии с различными веществами и может принимать электроны от них, изменяя свою структуру и образуя соответствующие соединения.
Применение Cu2O в различных отраслях науки и промышленности
1. Солнечные батареи: Оксид меди(I) (Cu2O) является перспективным материалом для создания экологически чистых солнечных батарей. Благодаря своим полупроводниковым свойствам, Cu2O способен преобразовывать солнечную энергию в электричество, что делает его важным компонентом в разработке эффективных и устойчивых источников энергии.
2. Сенсоры: Cu2O обладает хорошей чувствительностью к различным газам и может использоваться в создании газовых сенсоров. Это позволяет использовать этот материал в различных областях, включая мониторинг качества воздуха, безопасность и промышленный контроль.
3. Катализаторы: Оксид меди(I) также имеет каталитические свойства, которые могут быть использованы в различных химических процессах. Cu2O является активным катализатором в реакциях окисления органических соединений, полимеризации и дегидрирования.
4. Электроды: Благодаря своим электрическим свойствам, Cu2O может быть использован в качестве материала для создания электродов в электрохимических системах, включая аккумуляторы и электролизеры.
5. Красители и керамика: Кристаллическое Cu2O обладает красным цветом и используется как пигмент для красителей и керамики. Это позволяет создавать различные цветные материалы с помощью Cu2O.
6. Диэлектрические материалы: Редкие вещества на основе Cu2O, такие как оксиниты, обладают диэлектрическими свойствами и могут использоваться в радиотехнике и электронике для создания конденсаторов и других диэлектрических устройств.
7. Пиротехника: Кристаллическое Cu2O обладает замечательными пиротехническими свойствами. Он используется в составе пиротехнических смесей для различных эффектов, включая красное свечение и разноцветные вспышки.
Таким образом, Cu2O находит применение в различных областях, от энергетики до химической промышленности и электроники, благодаря своим уникальным свойствам и интересным физическим и химическим характеристикам. Этот материал продолжает привлекать внимание и исследователей, и инженеров, которые стремятся использовать его потенциал во благо человечества.
Влияние Cu2O на окружающую среду

Оксид меди(I) (Cu2O) является минералом, имеющим значительное влияние на окружающую среду. Взаимодействие Cu2O с атмосферным воздухом вызывает процесс окисления, что может привести к образованию загрязненного воздуха.
Одним из основных источников Cu2O в окружающей среде являются отходы медеплавильных производств. При сжигании меди и ее соединений в атмосферу эмитируются токсичные газы, в том числе оксиды меди. Следует отметить, что Cu2O обладает низкой эффективностью переработки и утилизации, что усложняет его удаление из окружающей среды.
- Положительное влияние Cu2O
- Как катализатор, Cu2O может участвовать в реакциях окисления органических веществ, что способствует очистке окружающей среды от загрязнений
- Отрицательное влияние Cu2O
- При высоких концентрациях Cu2O может иметь токсичное действие на живые организмы, вызывая различные заболевания и отравления
- Вода, попавшая в контакт с Cu2O, может становиться загрязненной и непригодной для питья и использования в сельском хозяйстве и промышленности
- Оксид меди может накапливаться в почвах и оказывать негативное влияние на растения, приводя к снижению урожайности и изменению физиологических процессов
В целом, влияние Cu2O на окружающую среду является комплексным и зависит от многих факторов, таких как концентрация, продолжительность воздействия и способы утилизации.
Экологические аспекты производства
Производство Cu2O имеет свои экологические аспекты, которые необходимо учитывать. Одним из главных аспектов является отходы, которые образуются в процессе производства. Их правильная обработка и утилизация позволяют снизить влияние на окружающую среду и создать более экологически безопасное производство.
Одним из наиболее опасных отходов является шлак, который образуется при выплавке Cu2O. Шлак содержит различные вредные вещества, которые могут негативно влиять на окружающую среду. Поэтому необходимо проводить специальную обработку шлака перед его утилизацией, чтобы изолировать опасные компоненты и предотвратить их попадание в почву или воду. Также возможно использование шлака в качестве вторичного сырья для производства других материалов.
Еще одним экологическим аспектом производства Cu2O является энергопотребление. Процессы, связанные с получением оксида меди, требуют большого количества энергии. Для уменьшения негативного влияния на окружающую среду рекомендуется использование возобновляемых источников энергии, таких как солнечная или ветровая энергия.
Кроме того, важно учитывать потребление воды в процессе производства Cu2O. Различные этапы производства могут требовать большого количества воды, что может привести к дефициту ресурса. В связи с этим необходимо применять методы эффективного использования воды, а также использовать рециркуляционные системы, которые позволяют повторно использовать воду и снизить потребление.
В целом, эффективное управление экологическими аспектами производства Cu2O позволяет снизить негативное воздействие на окружающую среду и создать более устойчивое и экологически безопасное производство.
Вопрос-ответ
Каковы основные свойства оксида металла Cu2O?
Оксид металла Cu2O обладает полупроводниковыми свойствами, имеет кубическую кристаллическую решетку и является кишечатым по структуре. Он обладает красноватым или коричнево-красным цветом и неполный октаэдрический кристаллический строение. Оксид металла Cu2O обладает высокой удельной теплоемкостью, твердостью и плотностью. Он также обладает полупрозрачностью в видимой части спектра и непрозрачностью в инфракрасной и ультрафиолетовой частях спектра.
Какие особенности оксида металла Cu2O наблюдаются при взаимодействии с кислородом?
При взаимодействии оксида металла Cu2O с кислородом происходит окисление металла до оксида. Также возможно образование многослойных структур оксида металла Cu2O, которые могут иметь различные свойства и составы в зависимости от условий взаимодействия.
Какие свойства неметаллического оксида Cu2O следует выделить?
Неметаллический оксид Cu2O обладает высокой электрической проводимостью, которая возникает за счет наличия дефектов в кристаллической решетке. Он также обладает свойствами полупроводника и может использоваться в различных электронных устройствах.
Каковы химические свойства оксида металла Cu2O?
Оксид металла Cu2O обладает щелочными свойствами и может реагировать с кислотами. Он также стабилен в нейтральной среде, но может окисляться в щелочной и окислительной средах. Оксид металла Cu2O не растворяется в воде, но может растворяться в растворах щелочей и кислот при нагревании.
Каковы применения оксида металла Cu2O в промышленности?
Оксид металла Cu2O имеет широкое применение в промышленности. Он используется в производстве полупроводниковых устройств, солнечных батарей, катализаторов, электроники и других технических сферах. Также оксид металла Cu2O применяется в производстве красок, стекла, керамики и других материалов.