Щелочные металлы – это группа элементов периодической таблицы, которые характеризуются низкой электроотрицательностью и активностью. Изначально они обычно находятся в состоянии ионов, обладающих положительным зарядом. На протяжении веков ученые изучали их свойства и применение в различных неорганических химических реакциях.
Цепочки превращений щелочных металлов начинаются с наличия ионов щелочного металла в растворе или в твердом состоянии. Эти ионы способны взаимодействовать с другими веществами и проводить различные химические реакции. Одним из важных способов использования щелочных металлов является образование свободных алканов, которые широко применяются в промышленности.
Преобразование ионов щелочных металлов в алканы – это сложный процесс, который включает в себя ряд реакций и ингибиторов, чтобы достичь желаемого продукта. Некоторые из этих реакций могут быть абсорбцией газа, гидрированием и каталитическим восстановлением. Процесс требует строгого контроля параметров, таких как температура, давление и концентрация реагентов.
Цепочки превращений щелочных металлов играют важную роль в различных областях, включая производство химических соединений, энергетику и материаловедение. Изучение этих процессов помогает понять основы неорганической химии и разработать новые методы синтеза веществ с определенными свойствами.
Изучение щелочных металлов в неорганической химии

Щелочные металлы – это элементы первой группы периодической системы химических элементов. К ним относятся литий, натрий, калий, рубидий, цезий и франций. Эти металлы обладают свойствами, которые делают их особенно интересными для исследования в области неорганической химии.
Изучение щелочных металлов в неорганической химии имеет большое значение для развития различных областей науки и технологии. Щелочные металлы широко применяются в различных промышленных процессах, в производстве лекарств и в разработке новых материалов. Научные исследования в области щелочных металлов способствуют разработке новых методов синтеза и модификации соединений, а также повышению эффективности их использования.
Одной из основных задач изучения щелочных металлов является исследование их химических свойств и реакций. Щелочные металлы реагируют с водой, кислотами, кислотными оксидами и другими реагентами, образуя различные соединения. Такие реакции являются основой для синтеза новых веществ и исследования их свойств.
Применение щелочных металлов в различных отраслях науки и промышленности возможно благодаря их уникальным свойствам. Например, натрий и калий широко применяются в производстве стекла и керамики, а также в батареях и аккумуляторах. Рубидий и цезий используются в оптических приборах и электронных устройствах. Литий, в свою очередь, является важным компонентом аккумуляторов для электро- и гибридных автомобилей.
Реакции цепочки превращений щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой активностью и способностью взаимодействовать с различными химическими соединениями. Они могут быть использованы в реакциях цепочки превращений, которые позволяют получать различные неорганические соединения.
Первым шагом в цепочке превращений щелочных металлов является реакция металла с водой. В результате этой реакции образуется щелочное гидроксидное соединение и выделяется водород. Например, натрий взаимодействует с водой, образуя гидроксид натрия и высвобождая водород:
2Na + 2H2O → 2NaOH + H2
Далее, щелочный гидроксид может быть использован в реакции с кислотой, что приводит к образованию поваренной или проявительной соли. Например, реакция гидроксида натрия с соляной кислотой приводит к образованию хлорида натрия и воды:
2NaOH + HCl → NaCl + H2O
После этого, хлорид натрия может быть использован в реакции с другими соединениями для получения различных продуктов. Например, хлорид натрия можно использовать для синтеза карбоната натрия:
2NaCl + H2CO3 → Na2CO3 + 2HCl
Таким образом, реакции цепочки превращений щелочных металлов позволяют получать широкий спектр неорганических соединений из простых и доступных исходных веществ.
Влияние щелочных металлов на структуру и свойства соединений
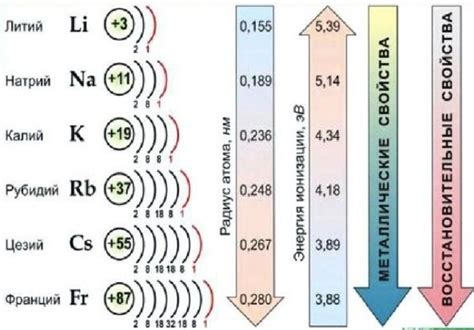
Щелочные металлы, такие как литий, натрий, калий и др., являются ключевыми элементами в неорганической химии. Их присутствие в соединениях может существенно влиять на их структуру и свойства.
Одним из основных эффектов, вызываемых щелочными металлами, является образование ионных связей. Щелочные металлы, благодаря низкой электроотрицательности и большому радиусу иона, могут легко отдавать свой внешний электрон и образовывать положительно заряженные ионы. Это позволяет им образовывать стабильные ионные соединения с различными антионами.
Другим важным эффектом щелочных металлов является их реакционная способность. Они обладают высокой активностью и могут легко взаимодействовать с различными веществами. Активация реакции благодаря присутствию щелочных металлов может привести к образованию новых соединений с измененными свойствами.
Кроме того, щелочные металлы могут оказывать влияние на кристаллическую структуру соединений. Они способны встраиваться в кристаллическую решетку и вносить необходимые изменения в ее структуру. Это может приводить к изменению прочности, термической устойчивости и другим физическим свойствам материалов.
Таким образом, щелочные металлы играют важную роль в неорганической химии, влияя на структуру и свойства соединений. Их присутствие может способствовать образованию стабильных ионных соединений, активации реакций и изменению кристаллической структуры материалов.
Характеристика различных типов реакций щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и др., обладают высокой активностью и способностью взаимодействовать с различными веществами. Реакции этих металлов могут быть различных типов в зависимости от условий и реагентов.
Одним из типов реакций щелочных металлов является реакция с водой. При взаимодействии с водой щелочные металлы образуют основания и выделяются водород. Так, натрий при контакте с водой образует гидроксид натрия и выделяет горючий водород, который может воспламеняться.
Еще одним типом реакций щелочных металлов является реакция с кислородом. При соприкосновении с кислородом щелочные металлы окисляются и образуют оксиды. Например, литий взаимодействует с кислородом и образует оксид лития.
Щелочные металлы также могут реагировать с кислотами. При взаимодействии с кислотами щелочные металлы образуют соль и выделяются газы. Например, натрий реагирует с соляной кислотой и образует хлорид натрия и выделяется хлороводородный газ.
Также щелочные металлы могут образовывать реакции с другими неорганическими веществами, такими как сера, фосфор и др. При этом образуются соответствующие соли. Например, при реакции калия с серой образуется сульфид калия.
В результате различных реакций щелочные металлы проявляют свою активность и участвуют в образовании разнообразных соединений. Правильное использование и понимание реакций щелочных металлов является важным аспектом в неорганической химии.
Использование щелочных металлов в синтезе неорганических соединений

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, широко используются в синтезе неорганических соединений. Они являются активными алкалиями, которые проявляют свою химическую активность благодаря наличию одного валентного электрона в своей внешней электронной оболочке.
Одним из основных способов использования щелочных металлов в синтезе неорганических соединений является их включение в реакционные смеси. Щелочные металлы могут реагировать с различными неорганическими соединениями, образуя новые соединения с различными свойствами. Например, добавление натрия в раствор алюминийхлористого кислоты приводит к образованию натрийалюминатного раствора, который можно использовать в производстве стекла.
Также щелочные металлы могут использоваться в качестве катализаторов при синтезе неорганических соединений. Они могут активировать реакции, позволяя производить целевые продукты с высокой эффективностью и выборкой. Например, калий может использоваться в качестве катализатора при синтезе аммиака, который является важным промышленным сырьем.
Важным аспектом использования щелочных металлов в синтезе неорганических соединений является их роль в формировании кристаллической структуры материалов. Щелочные металлы могут встраиваться в решетку других соединений, изменяя их свойства и улучшая их функциональность. Например, литий может встраиваться в кристаллическую структуру электродных материалов, увеличивая их энергетическую емкость.
Анализ экспериментальных данных о взаимодействии щелочных металлов
Щелочные металлы в неорганической химии представляют особый интерес из-за их активности и способности образовывать различные соединения. Для более глубокого понимания процессов взаимодействия щелочных металлов с другими веществами проводятся эксперименты, результаты которых позволяют сделать ряд выводов.
Экспериментальные данные о взаимодействии щелочных металлов представляют собой наблюдаемые изменения при добавлении щелочного металла к определенным соединениям или смесям веществ. Данные учитываются и анализируются для выявления закономерностей и определения условий, при которых происходят различные реакции.
Одним из основных параметров, учитываемых при анализе экспериментальных данных, является скорость реакции. Она позволяет определить, насколько быстро происходит взаимодействие щелочного металла с другим веществом. При проведении экспериментов изменяются такие параметры, как температура, концентрация веществ и наличие катализаторов для определения их влияния на скорость реакции.
Кроме скорости реакции, важными данными для анализа являются выходы продуктов реакции. Они позволяют определить, какие вещества образуются в результате взаимодействия щелочных металлов с другими соединениями. Выходы продуктов реакции зависят от многих факторов, включая исходные концентрации веществ, условия реакции и наличие примесей или катализаторов.
Для наглядного представления полученных данных обычно используются таблицы или графики. Они помогают визуализировать связи между различными параметрами и составлять численные или графические зависимости. Анализ экспериментальных данных о взаимодействии щелочных металлов позволяет сформулировать закономерности и прогнозировать результаты реакций, что является важным для дальнейшего исследования и применения в практике.
Возможности применения щелочных металлов в различных отраслях науки и техники

1. Энергетика: Щелочные металлы, такие как литий и натрий, используются в различных типах батарей и аккумуляторов. Например, литиевые ионные аккумуляторы широко применяются в современных электронных устройствах и электромобилях благодаря своей высокой энергоемкости и длительному сроку службы.
2. Катализ: Некоторые щелочные металлы, включая калий и цезий, используются в катализаторах для ускорения химических реакций. Они способны активировать различные соединения и увеличивать их реакционную активность, что может быть полезным, например, в синтезе органических соединений или в некоторых процессах очистки воды.
3. Металлургия: Щелочные металлы, особенно натрий и калий, широко применяются в металлургической промышленности. Натрий используется для плавки алюминия и других металлов, а калий – для получения легированных сталей и других сплавов. Они способствуют снижению температуры плавления металлов и улучшению их свойств.
4. Химическая синтез: Щелочные металлы, в основном натрий и калий, используются как реагенты при проведении различных химических реакций. Например, они могут служить источниками гидридов или галогенидов, а также участвовать в образовании комплексных соединений.
5. Электроника и оптика: Литий, рубидий и цезий широко применяются в электронике и оптике. Например, литий используется в производстве лазеров и приборов связи, а рубидий и цезий – в атомных часах и других точных измерительных приборах.
6. Фармацевтика: Некоторые щелочные металлы имеют медицинские применения. Например, литий используется в лекарствах для лечения биполярного расстройства и депрессии. Калий применяется как добавка в пищу и в медицинских препаратах для лечения сердечно-сосудистых заболеваний.
7. Работа с жидким аммиаком: Натрий и калий в реакции с аммиаком образуют аммиакаты, которые могут быть использованы для получения различных химических соединений. Также аммиакаты щелочных металлов являются важными компонентами некоторых промышленных удобрений.
Вопрос-ответ
Какие щелочные металлы используются в неорганической химии?
В неорганической химии часто используются щелочные металлы, такие как литий, натрий, калий, рубидий и цезий. Они имеют низкую электронную аффинность и высокую активность, что делает их полезными для различных химических реакций.
Какова роль щелочных металлов в неорганической химии?
Щелочные металлы играют важную роль в неорганической химии. Они могут служить в качестве катализаторов, ионных проводников, оснований, реагентов в различных синтезах и т.д. Их химические свойства и реактивность позволяют использовать их во многих процессах.
Какие реакции можно провести с щелочными металлами?
С щелочными металлами можно провести множество реакций. Например, с помощью натрия или калия можно провести реакцию с водой, образуя соответствующие гидроксиды и выделяя водород. Щелочные металлы также могут реагировать с кислородом, воздухом, некоторыми кислотами и многими другими веществами.
Какую роль играют щелочные металлы в жизни человека?
Щелочные металлы играют важную роль в жизни человека. Они используются в производстве батареек, стекла, мыла, а также в металлургии и в других отраслях промышленности. Кроме того, некоторые щелочные металлы, например, литий, используются в фармацевтике для производства лекарств.
Какие соединения могут образовывать щелочные металлы?
Щелочные металлы могут образовывать различные соединения, такие как оксиды, гидроксиды, соли и многие другие. Например, литий образует литийгидрид, натрий - натрия оксид, калий - калия гидроксид и так далее. В зависимости от окружающих условий и реагентов, щелочные металлы могут вступать в разные химические реакции и образовывать разные типы соединений.
