Процесс превращения металла в соль является сложным и многоэтапным. Один из путей, по которому это происходит, включает в себя образование оксида и последующее реагирование с основанием. Эта цепочка превращений является важной и широкоиспользуемой химической реакцией, которая приводит к образованию различных солей в естественных и промышленных процессах.
Первым этапом в этой цепочке является окисление металла. Под воздействием кислорода из воздуха или других окислителей металл превращается в соответствующий оксид. Оксиды обычно имеют разные степени окисления и физические свойства, но их основной химический состав состоит из металла и кислорода.
Далее происходит реакция оксида с основанием. Основание - это химическое соединение, способное сорбировать протоны и образовывать гидроксиды. Реакция оксида с основанием приводит к образованию гидроксида металла. В этой реакции металл в оксиде обменивает кислород на водород из основания, образуя гидроксид и освобождая воду.
Наконец, полученный гидроксид реагирует с кислотой, что приводит к образованию соли. В этой реакции протоны из кислоты сорбируются гидроксидом металла, образующим ион металла, а ионы кислоты образуют воду. Таким образом, цепочка превращений от металла до соли через оксид и основание завершается формированием стабильной соли, содержащей металл и кислотный остаток.
Цепочка химических превращений: от металла до соли через оксид и основание
Химические превращения позволяют нам изменять состав вещества и создавать новые соединения. Одной из таких цепочек превращений является цепочка "от металла до соли через оксид и основание". В результате этой цепочки мы можем получить соль, которая может использоваться в самых разных сферах жизни – от пищевой промышленности до медицины.
Первым шагом в этой цепочке является окисление металла. При взаимодействии металла со взбухающей или даже горящей какой-либо смесью случаются окислительные реакции. В результате такого взаимодействия образуется оксид металла, в котором металл уже находится в основном состоянии, а оксиген является отрицательным элементом.
Далее, вторым шагом в этой цепочке идет взаимодействие оксида металла с водой. В результате этого взаимодействия происходит гидратация оксида, что можно назвать реакцией гидролиза. В ходе гидролиза образуется основание – сильная щелочь, которая является гидратированным оксидом и растворяется очень легко в воде.
И, наконец, последним шагом в этой цепочке превращений является реакция основания с кислотой. В результате этой реакции образуется соль. Кислота делает основание нейтральным и образует воду, а соли получатся в растворе. Таким образом, мы можем получить различные соли, которые имеют разные свойства и применяются в разных областях нашей жизни.
Физические и химические свойства металлов
Металлы - это класс веществ, обладающих определенными физическими и химическими свойствами. Важнейшей характеристикой металлов является их электропроводность, периодическая система элементов подразделяет металлы на проводники и полупроводники.
Металлы отличаются хорошей теплопроводностью и теплоемкостью, благодаря чему они эффективно передают и сохраняют тепло. Это позволяет использовать металлы в различных областях, от строительства до электроники.
Химически металлы обычно обладают высокой реакционной способностью. Металлы легко вступают в химические реакции, образуя различные соединения, в том числе с кислотами и основаниями. Однако некоторые металлы могут быть устойчивыми к действию окружающей среды, что делает их практически не подверженными окислению и коррозии.
Металлы обладают высокой пластичностью и прочностью, что делает их идеальными материалами для производства различных конструкций и механизмов. Благодаря своим свойствам, металлы широко используются в различных областях промышленности и технологий, включая машиностроение, авиацию, электротехнику и многие другие.
Процесс окисления металлов и образование оксидов

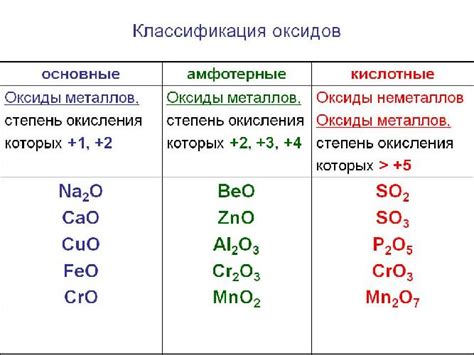
Оксиды являются важной группой химических соединений, которые образуются в результате окисления металлов. Окисление - это процесс, при котором металлы реагируют с кислородом и образуют соединения с кислородом, называемые оксидами.
Окисление металлов может происходить как при естественных условиях, так и под воздействием физических или химических факторов. Например, металлы могут окисляться на воздухе под воздействием кислорода. Также окисление может происходить при воздействии кислот, щелочей или других химических веществ.
Оксиды металлов имеют различные свойства и применяются в различных областях науки и техники. Некоторые оксиды, такие как оксид железа (Fe2O3) или оксид алюминия (Al2O3), широко используются в производстве красок, керамики и стекла. Другие оксиды, например оксид цинка (ZnO) или оксид меди (CuO), используются в электронике и солнечных батареях.
Процесс образования оксидов может быть описан следующей последовательностью превращений: сначала металл реагирует с кислородом, образуя оксид металла. Затем оксид может реагировать с водой или с щелочью, образуя основание. И, наконец, основание может реагировать с кислотой, образуя соль.
Sвойства и реактивность оксидов
Оксиды - это химические соединения, состоящие из атомов кислорода, связанных с другими атомами различных элементов. Они обладают различными свойствами и проявляют активность в химических реакциях.
Свойства оксидов зависят от элементов, которые образуют соединение. Некоторые оксиды являются кислотными, так как при растворении в воде они образуют кислотные растворы. Другие оксиды являются основными и образуют щелочные растворы.
Оксиды проявляют различную реактивность. Одни оксиды могут реагировать с водой, образуя кислоты или щелочи. Другие оксиды обладают высокой активностью и могут реагировать с другими веществами, вызывая взрывоопасные реакции или горение.
Оксиды также могут обладать свойствами окислителей или восстановителей. Некоторые оксиды способны окислять другие вещества, передавая им кислородные атомы. Другие оксиды могут восстанавливать окисленные вещества, отдавая кислородные атомы.
Свойства оксидов могут быть различными в зависимости от их структуры и химического состава. Некоторые оксиды обладают электрической проводимостью, что делает их полупроводниками или диэлектриками. Другие оксиды обладают магнитными свойствами или изменяют свои физические характеристики при изменении температуры.
Превращение оксидов в основания

Оксиды - это химические соединения, состоящие из атомов кислорода и других элементов. Они могут быть кислотными, щелочными или нейтральными. Щелочные оксиды могут превращаться в основания - вещества, способные образовывать гидроксиды и обладающие щелочными свойствами.
Превращение оксидов в основания происходит путем реакции оксида с водой. В результате реакции образуется гидроксид и высвобождается энергия. Это превращение также называется гидратацией оксида.
Некоторые оксиды образуют насыщенные растворы гидроксидов, такие как гидроксид натрия (NaOH) или гидроксид калия (KOH). Эти вещества широко используются в промышленности и бытовых целях. Гидроксиды обладают основными свойствами и могут реагировать с кислотами, образуя соли и воду.
Превращение оксидов в основания имеет важное значение в химической промышленности и в нашей повседневной жизни. Оно позволяет получать основания различной концентрации и использовать их в различных процессах, таких как очистка воды, производство мыла и многие другие.
Особенности реакций оснований с кислотами
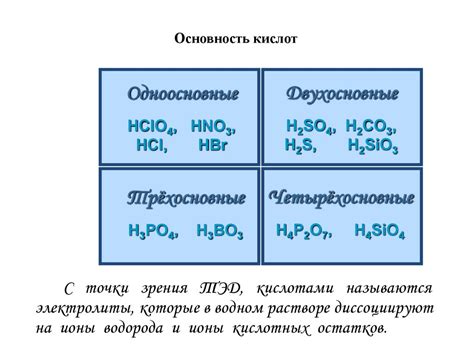
Реакции оснований с кислотами являются одним из фундаментальных процессов в химии. Основания и кислоты обладают особыми свойствами, которые определяют специфику этих химических взаимодействий.
Во-первых, реакции оснований с кислотами протекают с образованием соли и воды. Основания обладают свойством высвобождать отрицательные ионы (анионы) в растворе, а кислоты высвобождают положительные ионы (катионы). Эти ионы соединяются во время реакции и образуют соль, которая является продуктом взаимодействия.
Во-вторых, процесс образования соли и воды в результате реакции основания с кислотой сопровождается изменением pH раствора. Кислоты считаются кислотными соединениями и имеют низкий pH, в то время как основания считаются щелочными соединениями и имеют высокий pH. После реакции основание становится нейтральным компонентом, а pH раствора приближается к значению 7.
В-третьих, реакции оснований с кислотами могут протекать как в водных растворах, так и в твердом состоянии. В водных растворах основания и кислоты диссоциируют, образуя ионы, которые затем реагируют между собой. В твердом состоянии основание и кислота могут реагировать напрямую без диссоциации, что также приводит к образованию соли и воды.
Таким образом, реакции оснований с кислотами являются важными процессами в химии и находят широкое применение в различных областях науки, промышленности и повседневной жизни.
Образование солей при реакции оснований и кислот
Основания и кислоты являются важными классами химических соединений, и их реакция между собой играет ключевую роль в образовании солей. Реакция основания и кислоты называется нейтрализацией и происходит с образованием соли и воды.
Основания представляют собой соединения, способные отдавать гидроксидные ионы (OH-) в растворе. Кислоты, в свою очередь, обладают способностью отдавать протонные ионы (H+). При реакции нейтрализации протоны и гидроксидные ионы образуют воду, а катионы и анионы основания и кислоты образуют соль.
Например, реакция нейтрализации между соляной кислотой (HCl) и гидроксидом натрия (NaOH) приводит к образованию хлорида натрия (NaCl) и воды:
- Соляная кислота (HCl) + Гидроксид натрия (NaOH) → Хлорид натрия (NaCl) + Вода (H2O)
Подобные реакции могут происходить между различными кислотами и основаниями. Уравнение реакции определяет состав и свойства образовавшейся соли.
Образование солей при реакции оснований и кислот является важным процессом в химической промышленности, а также имеет широкое применение в жизни. Соли используются как пищевые добавки, удобрения, в процессе производства стекла и керамики, и во многих других областях.
Применение солей в различных отраслях промышленности
Соли широко используются в различных отраслях промышленности благодаря своим уникальным свойствам. В металлургии, например, соли используются в процессе электролиза для получения чистых металлов. Также соли применяются в гальваническом процессе для образования защитных покрытий на металлических изделиях.
В химической промышленности соли играют ключевую роль. Они используются в качестве катализаторов при синтезе органических соединений, а также в процессе образования кислот и щелочей. Соли также широко применяются в производстве удобрений, поскольку они содержат необходимые растениям макро- и микроэлементы.
В пищевой промышленности соли используются для консервирования пищевых продуктов, приготовления кисломолочных продуктов, выпечки и многих других процессов. Они помогают подчеркнуть вкус блюд, усиливая их аромат и сохраняя свежесть продуктов.
Соли имеют также широкое применение в фармацевтической промышленности. Они могут использоваться в процессе производства лекарств для усиления их эффекта или как составная часть непосредственно лекарства. Некоторые соли также используются в радиологии для подготовки пациента к проведению специальных исследований и процедур.
Соли находят применение и в таких отраслях, как текстильная промышленность, строительство, энергетика и др. Они могут использоваться в процессе окрашивания тканей, производства строительных материалов или в процессе очистки воды в котельных установках.
Вопрос-ответ
Какие превращения металла можно осуществить?
Металл можно превратить в оксид, основание и соль.
Как осуществить превращение металла в оксид?
Превращение металла в оксид можно осуществить путем окисления металла кислородом.
Что происходит при превращении металла в основание?
При превращении металла в основание, металл соединяется с гидроксидом и образует основание.
Как происходит превращение металла в соль через оксид и основание?
Превращение металла в соль происходит путем реакции оксида металла с кислотой, после чего образуется соль.
