Щелочноземельные металлы являются классом химических элементов, расположенных во второй группе Менделеевской таблицы. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Особенностью этих элементов является их свойство образовывать два положительных ионных заряда - +2 и +1. Это свойство называется валентностью щелочноземельных металлов.
Валентность щелочноземельных металлов имеет важное значение во многих химических реакциях. Благодаря наличию двух зарядов, эти металлы могут образовывать различные типы соединений. Наиболее распространенными в соединениях щелочноземельных металлов являются ионы +2 заряда. Они обладают примечательной стабильностью и способностью образовывать кристаллическую решетку с анионами других элементов.
Валентность щелочноземельных металлов также определяет их химическую реактивность. Ионы +1 заряда обладают большей активностью по сравнению с ионами +2 заряда. Их реакционная способность связана с возможностью потери одного электрона и образования соединений с отрицательно заряженными анионами. Именно эту валентность можно встретить в реакциях соединений кальция и стронция с кислородом, азотом и другими неталлическими элементами.
Валентность щелочноземельных металлов

Щелочноземельные металлы - это группа химических элементов, расположенных во второй группе периодической системы. Их атомы обладают двумя валентными электронами во внешней электронной оболочке. Валентность это свойство указывает на количество электронов, которыми атом может образовывать химические связи с другими атомами.
Валентность щелочноземельных металлов является постоянной и равна двум. Это означает, что атомы этих элементов могут образовывать две химические связи со свободными электронами у других атомов. Такая способность щелочноземельных металлов вступать в химические реакции определяется их электронной конфигурацией.
Валентность щелочноземельных металлов имеет важное значение для их химической активности. Ввиду наличия двух валентных электронов, атомы этих элементов стремятся отдать эти электроны и образовать положительный ион, чтобы достичь стабильной октаэдрической конфигурации.
Валентность щелочноземельных металлов влияет на их возможность образовывать соединения с различными элементами и их активность в различных химических реакциях. Например, они образуют ионы с положительным зарядом и активно взаимодействуют с анионами, такими как хлор или оксиды. Эти элементы также образуют многочисленные соединения с органическими соединениями и используются в многих промышленных процессах и технологиях.
Основные свойства щелочноземельных металлов
Щелочноземельные металлы – это группа химических элементов в периодической системе, включающая бериллий, магний, кальций, стронций, барий и радий. Они являются химически активными и обладают рядом особых свойств.
Первым свойством щелочноземельных металлов является их низкая электроотрицательность. Это позволяет им легко отдавать свои электроны при реакциях, что делает их отличными веществами для создания прочных металлических сплавов и проводников электричества.
Другим важным свойством щелочноземельных металлов является их высокая реакционная способность с водой и кислородом. Они реагируют с водой, выделяя водород и образуя щелочные растворы. Эта реакция является очень экзотермической и может протекать с высокой скоростью, особенно скаликие металлы, такие как барий и радий.
Щелочноземельные металлы также характеризуются высокой технической значимостью. Они широко используются в промышленности для производства легких сплавов, веществ для огнестойких материалов, лекарственных препаратов и т.д. Кроме того, они играют важную роль в биологических процессах организма, так как являются необходимыми микроэлементами для нормального функционирования клеток и тканей.
Выводя на путь истинный, химические свойства щелочноземельных металлов определяют их применение в различных отраслях науки и техники. Из-за своей активности и способности образовывать стабильные соединения, они являются неотъемлемой частью современных материалов и технологий.
Влияние валентности на химические реакции
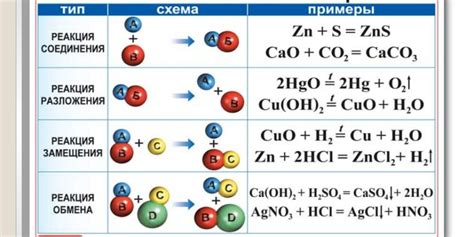
Валентность щелочноземельных металлов является одним из основных факторов, определяющих их химическую активность и участие в различных химических реакциях. Валентность – это количество свободных электронов, которыми может обменяться атом металла в процессе химической реакции.
Высокая валентность щелочноземельных металлов, таких как кальций, магний и барий, делает их очень реактивными и способными образовывать ионы. Именно благодаря этой способности они легко реагируют со многими другими веществами, включая кислоты, оксиды и галогены.
Валентность влияет на химическую активность металлов и их способность образовывать соединения. Например, гидроксид кальция, который образуется при реакции кальция с водой, является основным соединением и может использоваться в различных отраслях промышленности. Более высокая валентность металла, такая как наличие двух электронов для обмена, позволяет ему образовывать более стабильные ионы и соединения.
Кроме того, валентность влияет на свойства соединений, образуемых металлами. Например, окислительные свойства металлов могут изменяться в зависимости от валентности. Так, хром с валентностью +6 в соединениях является сильным окислителем, в то время как хром с валентностью +3 менее активен в окислительных реакциях.
Значение валентности для промышленных процессов
Валентность щелочноземельных металлов играет важную роль во многих промышленных процессах. Она определяет их химические свойства и позволяет использовать эти металлы для различных целей.
Одним из наиболее распространенных применений щелочноземельных металлов является их использование в производстве сплавов и легированных материалов. Благодаря своей низкой валентности, эти металлы способны образовывать прочные связи с другими элементами, что делает их важными компонентами в производстве сплавов с железом, алюминием и другими металлами.
Еще одним значимым применением щелочноземельных металлов связано с процессом очистки воды. Барам и стронцию валентность +2 позволяет использовать их соли в качестве коагулянтов для удаления загрязнений из воды. Эти металлы способны связываться с веществами, образовывая осадок, который затем можно удалить из воды фильтрацией или осаждением.
Кроме того, валентность щелочноземельных металлов имеет значение в химическом производстве. Например, бериллий с валентностью +2 используется в производстве ядерных реакторов, а магний с валентностью +2 широко применяется в производстве прочных и легких сплавов для авиационной и автомобильной промышленности.
Общаясь о значении валентности щелочноземельных металлов для промышленных процессов, нельзя не упомянуть их использование в электронике. Кальций и стронций, обладающие валентностью +2, находят широкое применение в светодиодных диодах и фосфорах, что делает их неотъемлемой частью современных электронных устройств.
Сравнение валентности щелочноземельных металлов

Валентность щелочноземельных металлов определяется количеством электронов, которые они могут отдать при образовании химических соединений. Эти металлы, включающие бериллий, магний, кальций, стронций, барий и радий, имеют неблагоприятные электрохимические свойства, что означает, что они отдают электроны, чтобы образовать положительные ионы.
Сравнение валентности щелочноземельных металлов позволяет понять их химическую активность и способность образовывать соединения с различными элементами. Бериллий имеет валентность +2, что означает, что он может отдать два электрона при образовании соединений. Магний также имеет валентность +2, в то время как кальций имеет валентность +2 или +1, в зависимости от условий.
Стронций образует соединения с валентностью +2, а барий — с валентностью +2. Радий, самый тяжелый щелочноземельный металл, имеет валентность +2, хотя он очень редкий и радиоактивный элемент.
Сравнение валентности щелочноземельных металлов помогает понять их химические свойства и их роль в различных химических реакциях. Валентность этих металлов определяет их способность образовывать стабильные соединения и их реактивность при контакте с другими веществами.
Общая характеристика валентности щелочноземельных металлов позволяет узнать, как эти элементы взаимодействуют с окружающей средой и как их соединения могут использоваться в различных областях промышленности и научных исследований.
Вопрос-ответ
Какова валентность щелочноземельных металлов?
Валентность щелочноземельных металлов составляет +2. Это означает, что эти металлы имеют два электрона в валентной оболочке.
Какую роль играют щелочноземельные металлы в химических реакциях?
Щелочноземельные металлы являются активными элементами, способными проявлять химическую активность при контакте с другими веществами. Они могут образовывать стабильные и нестабильные соединения с различными элементами.
Какие основные свойства щелочноземельных металлов?
Основные свойства щелочноземельных металлов включают высокую реактивность, низкую плотность, низкую температуру плавления, хорошую электропроводность и способность образовывать стабильные соединения с другими элементами.
Какую роль играют щелочноземельные металлы в природе?
Щелочноземельные металлы являются одними из наиболее распространенных элементов в земной коре. Они играют важную роль в формировании горных пород, почв и влияют на природные процессы.
Какие соединения образуют щелочноземельные металлы?
Щелочноземельные металлы образуют различные соединения, включая оксиды, гидроксиды, хлориды, сульфаты и другие. Эти соединения могут быть использованы в промышленности, медицине и других областях.
Каково значение щелочноземельных металлов для человека?
Щелочноземельные металлы имеют широкое применение в различных областях, таких как строительство, металлургия, энергетика, медицина и технологии. Они являются важными компонентами многих материалов и используются в производстве различных устройств и изделий.
Какие примеры можно привести щелочноземельных металлов?
Примеры щелочноземельных металлов включают бериллий, магний, кальций, стронций, барий и радий. Эти элементы имеют сходные химические свойства и встречаются в природе в виде различных соединений.
