Атомы являются основными строительными блоками всех веществ вокруг нас. Они состоят из электронов, протонов и нейтронов. Однако атомы металлов и неметаллов имеют свои особенности в строении и поведении.
Атомы металлов отличаются от атомов неметаллов основными свойствами. У атомов металлов наибольшее количество электронов во внешнем энергетическом уровне, что делает их склонными сдавать электроны при взаимодействии с другими атомами. Это объясняет проводимость металлов и их способность образовывать ионы положительного заряда.
Атомы неметаллов, напротив, имеют большее количество электронов во внешнем энергетическом уровне, что делает их склонными принимать электроны от других атомов. Это объясняет их свойство образовывать ионы отрицательного заряда и способность вступать в химические реакции с металлами.
Пример: Один из наиболее известных металлов - железо (Fe). Атом железа имеет 26 электронов, размещенных в трех энергетических уровнях. Внешний энергетический уровень содержит 8 электронов, что делает его атом особенно стабильным и склонным образовывать положительный ион.
Таким образом, строение атомов металлов и неметаллов определяет их основные химические свойства и взаимодействия. Понимание этих особенностей позволяет углубленно изучать и использовать металлы и неметаллы в различных областях науки и техники.
Строение атомов металлов

Атомы металлов обладают особыми свойствами, которые объясняют их высокую проводимость тепла и электричества, а также способность образовывать кристаллическую решетку.
В отличие от атомов неметаллов, у атомов металлов есть один или несколько свободных электронов в валентной оболочке, которые легко могут двигаться между атомами. Это свойство называется металлической связью и является основой для объяснения кондуктивности металлов.
Строение атомов металлов можно представить как сферическую ядро, вокруг которого вращаются электроны на разных энергетических уровнях. Ядро атома состоит из протонов и нейтронов, а электроны находятся на различных энергетических оболочках.
Кристаллическая решетка металла образуется благодаря тесному расположению атомов, связанных друг с другом металлическими связями. Эти атомы образуют регулярные структуры, наподобие сетки, что придает металлам их характерный металлический блеск и способность к деформации без разрушения.
Соответственно, из-за особого строения атомов металлы обладают особыми свойствами, которые делают их важными материалами в различных отраслях промышленности, науки и технологий.
Строение атомов неметаллов
Атомы неметаллов обладают своеобразным строением, отличающимся от атомов металлов. В отличие от металлов, неметаллы обычно образуют ковалентные связи, при которых атомы неметаллов обменивают пару электронов. Это позволяет образовывать молекулы, которые состоят из двух или более атомов.
Строение атома неметалла определяется его электронной конфигурацией. Атомы неметаллов имеют большое количество электронов в внешней оболочке, что делает их электронную конфигурацию более сложной, чем у атомов металлов. Неметаллы находятся в правом верхнем углу периодической таблицы и включают элементы такие, как кислород, фтор, сера и азот.
Электроны в атоме неметалла распределены на несколько энергетических уровней. Некоторые электроны находятся ближе к ядру и обладают более низкой энергией, а другие находятся на большем расстоянии от ядра и имеют более высокую энергию. Распределение электронов в атоме неметалла объясняет его химические свойства и способность образовывать различные соединения.
Атомы неметаллов могут образовывать связи с другими атомами неметаллов, образуя многоатомные молекулы. Неметаллы также могут образовывать ионы, изменяя свою зарядовую характеристику. Например, атом кислорода может получить два электрона от другого атома, образуя отрицательно заряженный ион оксида (O2-).
Особенности строения атомов металлов и неметаллов
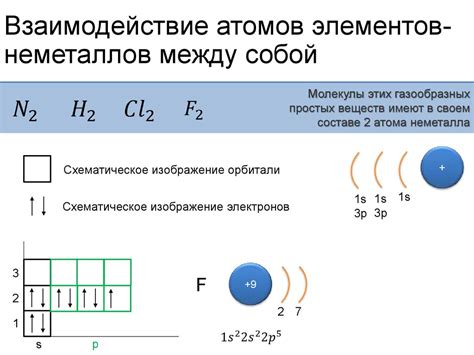
Строение атомов металлов и неметаллов имеет ряд особенностей, которые определяют их различие в химических свойствах и поведении. Одним из ключевых отличий между атомами металлов и неметаллов является число электронов в внешней электронной оболочке.
У атомов металлов в внешней оболочке находится от 1 до 3 электронов. Это позволяет им легко отдавать эти электроны другим атомам, образуя положительно заряженные ионы. Благодаря этому, атомы металлов обладают высокой электропроводностью и образуют металлические связи, которые обеспечивают их высокую пластичность и гибкость.
В отличие от металлов, атомы неметаллов имеют внешнюю электронную оболочку с 4 или более электронами. Их основным стремлением является принятие электронов от других атомов, чтобы заполнить свою внешнюю оболочку и достичь стабильной конфигурации. Это обеспечивает образование отрицательно заряженных ионов неметаллов и возможность образования ковалентных связей, необходимых для образования молекул.
Еще одной отличительной особенностью строения атомов металлов и неметаллов является наличие у металлов малого радиуса и высокой ядерной зарядности. Это обусловлено их высокой плотностью заряда в ядре, что делает металлы твердыми и хорошими проводниками тепла и электричества. Неметаллы, напротив, имеют большие радиусы и низкую ядерную зарядность, что делает их менее плотными и слабыми проводниками.
В итоге, строение атомов металлов и неметаллов определяет их химические свойства, такие как процессы ионизации, образование связей и молекул, а также электрические и термические свойства.
Пример строения атома металла
Атом металла представляет собой особую структуру, обладающую свойством металлической связи. В металлической связи электроны внешней оболочки атомов металла образуют так называемое "облако электронов", которое окружает ядро атомов. Такое облако электронов является общим для всех атомов в металле и обеспечивает его характерные физические и химические свойства.
Облако электронов в атоме металла имеет достаточно высокую подвижность. Это означает, что электроны могут свободно перемещаться внутри металла, создавая эффект электронного газа. Именно благодаря этим свободно движущимся электронам атомы металла способны проводить электрический ток и тепло.
Строение атома металла также предполагает наличие ядра, которое состоит из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Внешняя оболочка атомов металла содержит электроны с отрицательным зарядом, которые обеспечивают электронывзаимодействие атомов металла друг с другом.
Примером атома металла может служить атом железа (Fe). У атома железа внутренняя оболочка содержит 2 электрона, а внешняя оболочка - 8 электронов. В результате металлической связи атомы железа организуются в кристаллическую решетку, где каждый атом окружен несколькими соседними атомами. Такая структура дает железу его механическую прочность и позволяет придавать металлу разные формы.
Вопрос-ответ
Каково строение атомов металлов?
Строение атомов металлов характеризуется наличием металлического связывания. Атомы в металлической решетке располагаются близко друг к другу и образуют положительный ион - катион. Катионы окружены облаком свободно движущихся электронов, которые образуют так называемое «электронное море». Это делает металлы хорошими проводниками электричества и тепла.
Каково строение атомов неметаллов?
Строение атомов неметаллов характеризуется наличием ковалентной связи. Атомы в неметаллических соединениях образуют молекулы, которые состоят из двух или более атомов. В такой молекуле атомы связаны общими электронными парами. Ковалентные связи обычно образуются между атомами одного и того же неметалла, но могут также образовываться и между атомами разных элементов.
Каково строение атомов металла железа?
Атомы металла железа образуют кубическую решетку, известную как решетка гранецентрированного куба (ГЦК). Здесь каждый атом железа окружен восьмью ближайшими атомами, расположенными на вершинах куба, а также шестью атомами, расположенными на гранях куба. Такое строение обеспечивает высокую прочность и твердость металла железа.
Каково строение атомов неметалла кислорода?
Атомы неметалла кислорода образуют диатомическую молекулу O2. Каждый атом кислорода образует две ковалентные связи с другими атомами кислорода, образуя стабильную молекулу кислорода. Это строение позволяет кислороду образовывать различные соединения и играть важную роль в биологических и химических процессах.
