Щелочноземельные металлы представляют собой группу химических элементов, расположенных во второй группе периодической системы Менделеева. В этой группе находятся элементы магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы обладают рядом общих химических свойств, однако они отличаются друг от друга по многим параметрам, включая количество энергетических уровней у атомов.
Энергетические уровни атомов щелочноземельных металлов представляют собой орбитали, на которых располагаются электроны. Количество энергетических уровней определяется общим количеством электронов в атоме. Каждая орбиталь на энергетическом уровне может вмещать определенное количество электронов, в соответствии с правилами заполнения электронных оболочек.
Щелочноземельные металлы имеют общую конфигурацию электронных оболочек [металл]s^2, где [металл] обозначает один из элементов группы. Это означает, что у атомов щелочноземельных металлов имеется два электрона на последнем энергетическом уровне. Конфигурация электронных оболочек придает этим металлам некоторые общие химические свойства, такие как высокая активность в реакциях с водой и образование ионов с двойным положительным зарядом.
Однако, несмотря на общую конфигурацию электронных оболочек, количество энергетических уровней у атомов щелочноземельных металлов может отличаться. Например, у магния и кальция наиболее энергетический уровень занят двумя электронами, тогда как у стронция и бария он занят четырьмя электронами. Подобные различия в энергетических уровнях обусловлены исключительно разным количеством электронов, которые металлы имеют на последних энергетических уровнях своих атомов.
Что такое энергетические уровни атомов
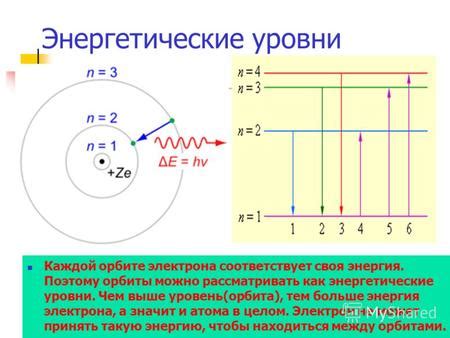
Энергетические уровни атомов представляют собой дискретные значения энергии, на которых находятся электроны в атоме. Электроны в атомах могут занимать только определенные энергетические уровни, а между этими уровнями существуют запретные зоны, на которых электроны не могут находиться. Каждый энергетический уровень соответствует определенной энергии электрона.
Электроны в атомах щелочноземельных металлов находятся на различных энергетических уровнях в соответствии с принципом заполнения электронных оболочек. В атомах этих металлов наиболее близким к ядру находится внутренняя s-оболочка, которая содержит 2 электрона. За этой оболочкой находится следующая p-оболочка, которая включает 6 электронов.
Щелочноземельные металлы имеют в своих атомах 2 энергетических уровня - 2s и 2p. На энергетическом уровне 2s находятся два электрона, а на уровне 2p - шесть электронов. Такое различное количество энергетических уровней обусловлено особенностями строения электронных оболочек в атомах щелочноземельных металлов.
Описание энергетических уровней атомов
Энергетические уровни атомов являются основными состояниями энергии, в которых находятся электроны. Каждый уровень определяет возможные значения энергии, на которых может находиться электрон в атоме. Уровни выстраиваются вокруг ядра атома по принципу энергетической лестницы, где более близкие к ядру электроны обладают меньшей энергией.
Природа энергетических уровней атомов щелочноземельных металлов отличается от уровней других элементов. У этих металлов есть всего два энергетических уровня, которые заполняются электронами. На первом уровне может находиться максимум 2 электрона, а на втором – 8 электронов. Это обусловлено особенностями электронной конфигурации атомов щелочноземельных металлов, где сначала заполняется внутренний энергетический уровень (n-1) и только потом – внешний (n).
Различие в количестве энергетических уровней у атомов щелочноземельных металлов имеет важные подвижки на их химические свойства. Благодаря наличию внешних электронов, атомы щелочноземельных металлов обладают высокой химической активностью и устойчивостью, причем активность возрастает с увеличением количества электронов на внешнем энергетическом уровне. Эти металлы с легкостью образуют ионные и ковалентные связи, и являются основными компонентами многих минералов и природных соединений.
Особенности энергетических уровней у атомов щелочноземельных металлов
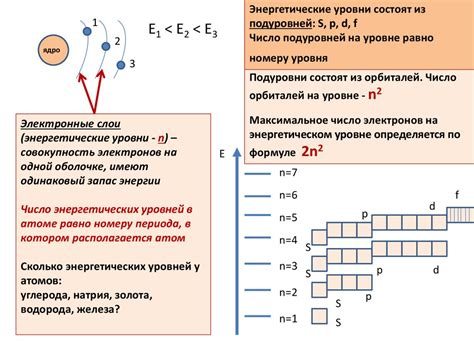
Атомы щелочноземельных металлов, таких как бериллий, магний, кальций и другие, имеют свои особенности в уровнях энергии электронов. Эти металлы находятся во второй группе периодической таблицы и обладают общей химической характеристикой - наличием двух электронов во внешней энергетической оболочке.
У атомов щелочноземельных металлов энергетические уровни расположены в основном на трех главных квантовых числах - n=2, n=3 и n=4. Первый энергетический уровень (n=1) занят двумя электронами с полным заполнением s-подуровня. За счет этого, атомы щелочноземельных металлов обладают большей стабильностью и меньшей реакционной способностью по сравнению с другими атомами.
По мере увеличения главного квантового числа n, происходит увеличение энергетического уровня электронов. На каждом уровне могут находиться различные подуровни электронов - s, p, d и f. У атомов щелочноземельных металлов, энергетические уровни заполняются по принципу Паули и запрещении Гунда. Это означает, что электроны занимают доступные подуровни в порядке возрастания энергии.
Благодаря особенностям энергетических уровней, атомы щелочноземельных металлов обладают свойствами легко образовывать соединения с другими элементами. Уже на втором энергетическом уровне у атомов этих металлов имеются доступные s-подуровни, что способствует их активности в химических реакциях. Однако, по мере увеличения атомного номера и энергетических уровней, атомы щелочноземельных металлов становятся менее реакционноспособными.
Примеры энергетических уровней у атомов щелочноземельных металлов
Бериллий (Be):
У атома бериллия обнаруживается два энергетических уровня: первый и второй. На первом уровне находится два электрона, а на втором – два электрона. Это объясняется фактом, что атом бериллия имеет атомный номер 4, что означает наличие 4 электронов в оболочках.
Магний (Mg):
У атома магния имеются три энергетических уровня: первый, второй и третий. На первом уровне находится два электрона, на втором – восемь, а на третьем – два. Это связано с тем, что магний имеет атомный номер 12 и содержит соответствующее количество электронов в своих оболочках.
Кальций (Ca):
У атома кальция можно обнаружить четыре энергетических уровня: первый, второй, третий и четвертый. На первом уровне находится два электрона, на втором – восемь, на третьем – восемь, а на четвертом – два. Такой набор уровней связан с атомным номером 20 кальция, определяющим количество электронов в его оболочках.
Стронций (Sr):
У атома стронция представлены пять энергетических уровней: первый, второй, третий, четвертый и пятый. На первом уровне находятся два электрона, на втором – восемь, на третьем – восемь, на четвертом – два, а на пятом – два. Атомный номер 38 стронция определяет количество электронов в его оболочках и, следовательно, количество энергетических уровней.
Барий (Ba):
У атома бария можно наблюдать пять энергетических уровней: первый, второй, третий, четвертый и пятый. На первом уровне расположены два электрона, на втором – восемь, на третьем – восемь, на четвертом – восемь, а на пятом – два. Это обусловлено атомным номером 56 бария, определяющим количество электронов в его оболочках и количество энергетических уровней.
Значение количества энергетических уровней для свойств атомов щелочноземельных металлов
Щелочноземельные металлы - это элементы, которые расположены во второй группе периодической системы. У атомов этих металлов отличается количество энергетических уровней, которое влияет на их свойства и химическую активность.
Количество энергетических уровней у атомов щелочноземельных металлов определяет структуру электронной оболочки атома. Уровни энергии представляют возможные значения энергии, которые электрон атома может иметь. Чем больше энергетических уровней у атома щелочноземельного металла, тем больше электронов может быть на каждом уровне и тем больше электронов может атом в целом содержать.
Атомы щелочноземельных металлов обладают от двух до четырех энергетических уровней. Наличие нескольких уровней позволяет атомам формировать различные связи с другими атомами и ионами. Например, атомы магния и кальция, которые имеют два энергетических уровня, могут образовывать ионы с положительным зарядом +2.
Количество энергетических уровней также влияет на химическую активность атомов щелочноземельных металлов. Чем больше уровней, тем меньше энергии необходимо для перехода одного или нескольких электронов с одного уровня на другой. Это делает атомы этих металлов более реакционноспособными и способными образовывать соединения с другими элементами.
Вопрос-ответ
Почему у атомов щелочноземельных металлов различное количество энергетических уровней?
Различное количество энергетических уровней у атомов щелочноземельных металлов обусловлено структурой их электронной оболочки. Каждый энергетический уровень соответствует разрешенным значениям энергии, на которых электроны могут находиться. Уровни энергии формируются в результате взаимодействия электронов с ядром атома и другими электронами. У атомов щелочноземельных металлов электронная конфигурация определяется количеством электронов на внешнем энергетическом уровне, который состоит из s-электронов. Следовательно, у атомов щелочноземельных металлов количество энергетических уровней связано с количеством электронов на внешнем энергетическом уровне.
Какие щелочноземельные металлы имеют большее количество энергетических уровней?
У атомов щелочноземельных металлов количество энергетических уровней зависит от количества электронов на внешнем энергетическом уровне. Большее количество энергетических уровней имеют атомы щелочноземельных металлов, у которых на внешнем энергетическом уровне находятся больше электронов. Например, у атома бария есть 6 энергетических уровней, так как на его внешнем энергетическом уровне находятся 2 электрона, в то время как у атома кальция есть 4 энергетических уровня, так как на его внешнем энергетическом уровне находятся 2 электрона.
Как энергетические уровни атомов щелочноземельных металлов связаны с их химическими свойствами?
Энергетические уровни атомов щелочноземельных металлов связаны с их химическими свойствами. Уровни энергии влияют на то, как атомы вступают в химические реакции и взаимодействуют с другими атомами. Например, щелочноземельные металлы с большим количеством энергетических уровней более активны химически, так как их внешние электроны находятся на более высоких энергетических уровнях и меньше связаны с ядром. Это позволяет им легко отдавать электроны и образовывать ионы положительной заряды.
