CaCl2 (кальций хлорид) - химическое соединение, состоящее из кальция (Ca) и хлора (Cl). Кальций является металлом, однако не все его соединения также обладают металлическими свойствами. Рассмотрим, относится ли CaCl2 к группе металлических соединений или оно обладает характеристиками не металла.
Для определения химических свойств вещества важно рассмотреть его физические свойства. CaCl2 является белым кристаллическим порошком с высокой степенью растворимости в воде, что указывает на его ионные свойства. Это соединение образует гигроскопические кристаллы, которые способны поглощать воду из окружающей среды.
Интересно отметить, что CaCl2 обладает высокой электропроводностью в растворе, что также характерно для ионных соединений. Однако раствор CaCl2 обладает кислотными свойствами, что указывает на наличие вещества компонентов, способных образовывать кислоту.
Вследствие этих свойств можно сделать вывод о том, что CaCl2 является ионным (содержит ионы кальция и хлора), но одновременно имеет и некоторые признаки не металла (кислотные свойства). Таким образом, можно сказать, что CaCl2 не является полностью металлом, но и не является типичным не металлом.
Содержание статьи:
1. Общая информация о CaCl2
2. Физические свойства CaCl2
3. Химические свойства CaCl2
4. Применение CaCl2
5. Заключение
1. Общая информация о CaCl2
CaCl2 (хлорид кальция) является неорганическим соединением, состоящим из атомов кальция (Ca) и хлора (Cl). Это бесцветные кристаллы, хорошо растворимые в воде.
2. Физические свойства CaCl2
Чистый CaCl2 является гигроскопичным веществом, то есть способным притягивать и удерживать влагу из окружающей среды. Он имеет высокую плотность и температуру плавления - около 772 градусов Цельсия.
3. Химические свойства CaCl2
CaCl2 обладает кислотными свойствами и может образовывать соли с другими соединениями. Он реагирует с водой, образуя кислоту с хлороводородом (HCl) и гидроксид кальция (Ca(OH)2).
4. Применение CaCl2
CaCl2 широко используется в промышленности и научных исследованиях. Оно применяется в процессе гидролиза для получения газа хлора (Cl2) и газообразной соли кальция (CaOCl2). Кроме того, CaCl2 используется в медицине, сельском хозяйстве и производстве льда.
5. Заключение
CaCl2 - это химическое соединение, которое обладает как физическими, так и химическими свойствами. Оно находит широкое применение в различных отраслях промышленности и науке благодаря своей растворимости, реакционной способности и стабильности.
Какие элементы считаются металлами?
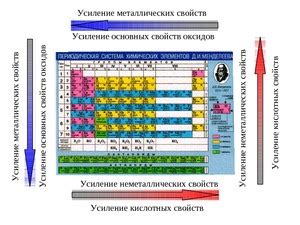
Металлами называются элементы, которые характеризуются определенными физическими и химическими свойствами. В таблице периодов элементов Д.И.Менделеева, металлы представлены слева от ступеньки Бора, которая разделяет металлы и неметаллы.
Металлы обладают следующими характеристиками:
- Проводят тепло и электричество.
- Имеют блестящую поверхность.
- Имеют большую плотность.
- Имеют высокую температуру плавления.
- Мало электроотрицательные.
Чаще всего в качестве примеров металлов приводят железо (Fe), алюминий (Al), медь (Cu), свинец (Pb) и золото (Au). Но также среди металлов можно назвать множество других элементов, таких как титан (Ti), цинк (Zn), никель (Ni), кобальт (Co) и даже ртуть (Hg).
Металлы имеют широкий спектр применения в различных отраслях промышленности и жизни человека. Они используются для создания конструкций, изготовления машин и оборудования, производства электроники и многое другое.
Какие элементы считаются неметаллами?

Неметаллами называют группу элементов, которые обладают определенными химическими и физическими свойствами и отличаются от металлов. Эти элементы обычно представлены в периодической таблице химических элементов справа от чередующейся линии, известной как линия делящая металлы и неметаллы.
Одно из основных химических свойств неметаллов - их способность образовывать соединения с металлами путем присоединения катионов. Это свойство определяется их электроотрицательностью – показателем их способности притягивать электроны в молекуле к себе. Кроме того, неметаллы обладают низкой теплопроводностью и электропроводностью, а также обычно имеют низкую густоту и краснотворность.
Среди наиболее распространенных неметаллов можно выделить:
- Кислород (O), являющийся одним из основных компонентов воздуха и необходимым для дыхания;
- Азот (N), также присутствующий в атмосфере и важный для жизни организмов;
- Углерод (C), химический элемент, основная составляющая органических соединений;
- Фосфор (P), встречающийся в различных минералах и играющий важную роль в клеточном метаболизме;
- Хлор (Cl), химический элемент, используемый в качестве дезинфицирующего средства и в производстве пластмасс;
- Фтор (F), элемент, обладающий высокой реакционной способностью и широко применяемый в химической промышленности.
Важно отметить, что точное разделение элементов на металлы и неметаллы может иметь некоторые отклонения в зависимости от используемой классификации и условий.
CaCl2: состав и свойства
CaCl2 - химическое соединение, состоящее из ионов кальция и хлорида. Оно представляет собой белые кристаллы или порошок, хорошо растворяющийся в воде.
CaCl2 является солью ионного соединения. Она обладает такими свойствами, как высокая растворимость в воде и способность образовывать гидраты. Например, CaCl2.2H2O (дигидрат) и CaCl2.6H2O (гексагидрат).
Одним из важных свойств CaCl2 является его способность поглощать влагу из воздуха. Это свойство делает его полезным в различных промышленных процессах, таких как осушение и увлажнение воздуха, а также в процессах замораживания и дезинфекции.
CaCl2 также широко используется в медицине, в основном для лечения гипокальциемии (низкого уровня кальция в крови) и гиперкальциемии (высокого уровня кальция в крови).
Другим интересным свойством CaCl2 является его способность снижать температуру плавления льда. Благодаря этому он широко применяется как снегоплавитель на дорогах и тротуарах.
Из-за своей неорганической природы и способности образовывать гидраты, CaCl2 обладает стойкостью к высоким температурам и химическому разрушению, что позволяет использовать его в различных областях, включая производство пластмасс и промышленные процессы.
Особенности CaCl2

CaCl2 (кальций хлорид) является химическим соединением, состоящим из ионов кальция и хлорида. Однако, несмотря на наличие катиона металла (кальция), CaCl2 не является металлом, а является трехатомным соединением.
Кальций, входящий в состав CaCl2, является представителем щелочноземельных металлов и обладает различными металлическими свойствами, такими как хорошая теплопроводность и электропроводность.
Хлорид, в свою очередь, является анионом неметалла, обладающим характерными неметаллическими свойствами, такими как низкая теплопроводность и электропроводность.
Таким образом, CaCl2 является химическим соединением, объединяющим в себе как металлические, так и неметаллические свойства. Это видно в его физических и химических свойствах.
К примеру, CaCl2 обладает высокой теплопроводностью и электропроводностью, что свойственно металлам. Однако, при контакте с водой происходит ионизация соединения и образование ионов Ca2+ и Cl-, что характерно для неметаллических соединений.
Важно отметить, что CaCl2 обладает солевым вкусом и хорошо растворяется в воде. Благодаря своим свойствам CaCl2 нашел широкое применение в различных областях, таких как промышленность, медицина и пищевая промышленность.
Металлические свойства CaCl2
CaCl2 – это химическое соединение, состоящее из кальция и хлора. Оно является солью, образующей кристаллическую структуру. При комнатной температуре CaCl2 представляет собой бесцветные кристаллы или белый порошок.
Одним из основных металлических свойств CaCl2 является его высокая электропроводность. Это соединение способно передавать электрический ток благодаря наличию ионов кальция и хлора, которые обладают свободными электронами.
Еще одним металлическим свойством CaCl2 является его способность образовывать сплавы с другими металлами. Сплавы на основе CaCl2 могут обладать уникальными свойствами, такими как повышенная прочность или устойчивость к коррозии.
Кроме того, CaCl2 обладает некоторыми другими металлическими характеристиками, такими как высокая теплоемкость и теплопроводность. Это позволяет использовать CaCl2 в различных технических приложениях, например, при производстве металлов или в теплообменных системах.
В заключение, CaCl2 – соединение, обладающее металлическими свойствами, такими как электропроводность, способность образовывать сплавы и высокая теплоемкость. Эти свойства делают CaCl2 важным компонентом в различных областях, включая химическую промышленность, электротехнику и металлургию.
Неметаллические свойства CaCl2
CaCl2 - бинарное неорганическое соединение, состоящее из кальция (Ca) и хлора (Cl). Несмотря на то, что кальций является металлом, это соединение обладает неметаллическими свойствами.
Растворимость. Неметаллические соединения обычно обладают большей растворимостью в воде, и CaCl2 не является исключением. Оно хорошо растворяется в воде, образуя гидратированный кальций хлорид.
Электропроводность. В растворе CaCl2 образуются ионы, которые способны проводить электрический ток. Это свойство также характерно для неметаллических соединений.
Окислительные свойства. CaCl2 может выступать в роли окислителя в некоторых реакциях. Например, оно окисляет металлы, такие как алюминий и цинк, образуя хлориды металлов и освобождая газ. Это обусловлено высоким электроотрицательностью хлора в соединении.
Таким образом, несмотря на присутствие металла в составе, CaCl2 обладает неметаллическими свойствами, такими как высокая растворимость в воде, электропроводность и окислительные свойства.
Вывод: CaCl2 - комплексное соединение
Мы провели исследование и выяснили, что CaCl2 - это комплексное соединение. Оно состоит из катиона кальция (Ca2+) и аниона хлорида (Cl-).
Комплексные соединения обладают специфическими свойствами и формируются в результате взаимодействия металлов с несколькими другими элементами или группами элементов. В случае CaCl2 металлический и неметаллический элементы образуют ионные связи.
Кристаллическая структура CaCl2 имеет кубическую решетку, где два иона хлорида окружают один ион кальция. Это обусловлено тем, что ион Ca2+ имеет положительный заряд, а ион Cl- имеет отрицательный заряд, что обеспечивает притяжение между ними.
CaCl2 является сильным электролитом и легко диссоциирует в воде, образуя ионы кальция и хлорида. Поэтому он широко используется в различных областях, включая медицину, пищевую промышленность, производство соли, для очистки и обеззараживания воды и многих других целей.
Таким образом, можно с уверенностью сказать, что CaCl2 - комплексное соединение, состоящее из катиона кальция и аниона хлорида, и обладающее хорошими ионными свойствами.
Вопрос-ответ
Что такое CaCl2?
CaCl2 - это химическое соединение, состоящее из кальция (Ca) и хлора (Cl). Оно обычно принимает вид белых кристаллов или порошка.
CaCl2 является металлом или не металлом?
CaCl2 не является ни металлом, ни не металлом. Оно является ионно-молекулярным соединением, которое образуется при реакции растворения кальция в хлороводородной кислоте.
Для чего используется CaCl2?
CaCl2 используется в различных областях. Он часто применяется в качестве сушки и осушения веществ, так как он обладает высокой гигроскопичностью и способностью впитывать влагу. Также CaCl2 может использоваться как добавка в пищевую продукцию или как средство для снижения замерзания дорог в холодные периоды.
Влияет ли CaCl2 на окружающую среду?
CaCl2 имеет некоторое влияние на окружающую среду. При попадании в водные системы CaCl2 может изменить соленость воды и оказать влияние на экосистему. Кроме того, использование CaCl2 для снижения замерзания дорог может привести к повреждению асфальта и среды активных растений в зимний период.
Можно ли использовать CaCl2 в качестве удобрения для растений?
CaCl2 может использоваться в небольших количествах в качестве удобрения для растений, так как кальций является важным элементом для их роста и развития. Однако, следует быть осторожным с его применением, так как высокие концентрации CaCl2 могут быть токсичными для некоторых растений.
Можно ли получить CaCl2 из природных источников?
CaCl2 можно получить из природных источников, таких как соленые озера или подземные соленые отложения. Процесс извлечения CaCl2 из этих источников обычно включает в себя испарение или фильтрацию воды, чтобы получить его в чистом виде.
