Медь является одним из самых распространенных металлов, который имеет множество применений в различных отраслях промышленности и повседневной жизни. В то же время сера тоже весьма важный элемент, который применяется в различных формах, включая серу в природной форме, серу в составе нефти или в виде серных соединений. Уравнение реакции металла меди с серой прояснит, как медь и сера взаимодействуют и образуют соединение.
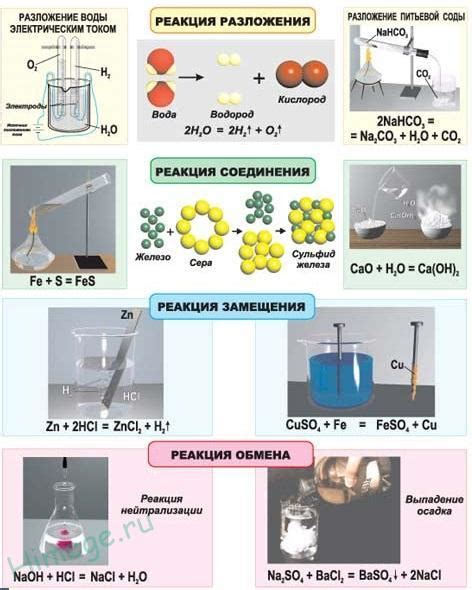
Уравнение реакции металла меди с серой можно представить следующим образом: Cu + S → CuS. При этом медь (Cu) и сера (S) соединяются и образуют соединение меди с серой (CuS). Отметим, что данная реакция является главной реакцией формирования минерала медь-пирит (CuFeS2), который является важным рудным минералом меди. Также стоит отметить, что данное уравнение представляет идеализированную реакцию, поскольку фактическая реакция в реальных условиях может протекать с образованием дополнительных продуктов.
Реакция металла меди с серой является одной из многих реакций, которые могут происходить между металлическими элементами и химическими соединениями. Эти реакции могут протекать при различных условиях и в зависимости от температуры, давления и наличия катализаторов могут приводить к образованию различных соединений. Изучение таких реакций позволяет нам лучше понять химические свойства элементов и их взаимодействие с другими веществами.
Описание процесса
Уравнение реакции металла меди с серой является примером реакции окисления-восстановления. В данном случае медь окисляется, образуя сульфид меди. Реакция происходит следующим образом:
- Металлическая медь (Cu) вступает в контакт с молекулами серы (S).
- Под воздействием тепла или катализатора, атом меди отдает 2 электрона и окисляется в ион меди с двойным положительным зарядом (Cu2+).
- При этом молекулы серы принимают эти электроны и восстанавливаются до анионов с отрицательным зарядом, образуя сульфид меди (CuS).
Уравнение реакции выглядит следующим образом:
2Cu + S → Cu2+ + S2- → CuS
Реакция металла меди с серой имеет важное применение в промышленности, например, в химическом производстве или производстве металлургических материалов. Она также широко изучается в рамках учебной программы по химии. Знание процесса реакции позволяет более глубоко понять принципы окислительно-восстановительных реакций и их применение в различных областях науки и промышленности.
Ролевое значение металла меди
Медь – один из самых распространенных металлов на Земле, обладающий широким спектром применения и важным ролевым значением в различных отраслях человеческой деятельности.
Электротехника и электроника: Медь является одним из лучших проводников электричества. Ее высокая электропроводность обеспечивает эффективную передачу электрического тока и позволяет создавать электрические цепи с минимальными потерями энергии. Благодаря этим свойствам, медь широко применяется в производстве электродов, кабелей, проводов, электронных компонентов и других устройств.
Строительство и архитектура: Медь обладает высокой устойчивостью к различным воздействиям окружающей среды, включая коррозию. Из-за своей прочности и долговечности, медь широко используется при создании кровельных покрытий, трубопроводов, фасадных элементов и декоративных элементов. Ее красивый золотисто-красный цвет и способность приобретать патину делают медь популярным материалом для архитектурных проектов.
Медицина: Медь имеет антибактериальные свойства, поэтому ее применяют в медицинских инструментах, а также при создании антибактериальных поверхностей и материалов. Благодаря способности выводить токсины из организма, медь также используется в производстве лекарственных препаратов и добавок, например, медных браслетов и монет для поддержания здоровья.
Производство монет: Медь была одним из первых материалов, используемых для изготовления монет. Во многих странах монеты из меди являются обычным средством расчета и имеют коллекционную ценность.
Искусство и ювелирное дело: Изделия из меди широко используются в производстве украшений и предметов искусства. Медь благородно сияет, дополняет и акцентирует красоту драгоценных камней, а ее мягкость позволяет легко воплотить сложные и оригинальные формы и узоры.
Промышленность: Медь является неотъемлемым материалом в промышленности. Она используется при производстве различных сплавов, включая латунь и бронзу, которые востребованы в автомобильной, машиностроительной и других отраслях промышленности.
Важность серы в химической реакции
Сера является важным компонентом во многих химических реакциях, включая реакцию металла меди с серой. Сера имеет особое значение в данной реакции, так как она дополняет и позволяет достичь полной окислительной реакции.
Реакция металла меди с серой представляет собой окислительно-восстановительную реакцию, в результате которой образуется медный сульфид (CuS). Сера в данной реакции выступает в роли окислителя, т.е. получает электроны от меди, в результате чего происходит окисление меди.
Кроме того, сера играет важную роль в стабилизации реакционной среды. Она образует соединение с металлом, позволяя удерживать его в растворе и предотвращая его осаждение. Это очень важно, так как иначе реакция могла бы протекать неправильно или замедляться.
Еще одним аспектом важности серы в данной химической реакции является ее роль в катализаторе. Сера ускоряет реакцию и позволяет ей протекать при более низкой температуре, что значительно экономит энергию. Кроме того, сера также обеспечивает высокую чистоту получаемого продукта, что важно для его дальнейшего применения.
В целом, сера играет важную роль в реакции металла меди с серой, обеспечивая ее нормальное протекание, стабильность и повышенную эффективность. Без присутствия серы реакция не могла бы протекать так эффективно и давать качественные продукты.
Способы проведения эксперимента
Для проведения эксперимента с уравнением реакции металла меди с серой необходимо использовать следующие способы:
- Применение вещества для реакции: В качестве металла меди можно использовать фольгу, проволоку или порошок меди. Для реакции с серой можно использовать элементарную серу или соединения серы, например, серный порошок.
- Выбор условий реакции: Для проведения эксперимента необходимо выбрать условия, при которых происходит реакция меди с серой. Это может быть нагревание вещества до определенной температуры, добавление катализатора или других реагентов.
- Наблюдение за ходом реакции: Во время проведения эксперимента необходимо внимательно наблюдать за ходом реакции. Можно записывать изменения цвета вещества, образование новых соединений или выделение газов.
- Измерение полученных данных: После окончания реакции необходимо измерять полученные данные, такие как масса продуктов реакции, объем выделенного газа или изменение температуры. Для этого можно использовать различные инструменты и приборы, такие как весы, мерный цилиндр или термометр.
- Формулировка уравнения реакции: На основе полученных данных и наблюдений необходимо сформулировать уравнение реакции металла меди с серой. Уравнение должно отражать все входящие и выходящие вещества и правильно сбалансировано.
Альтернативные реакции
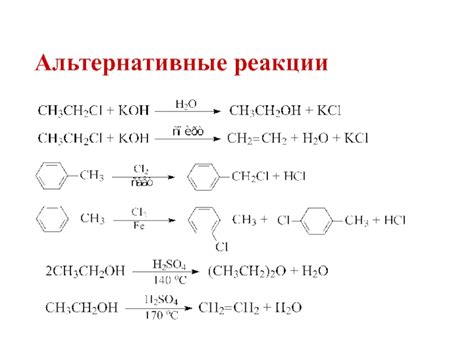
1. Реакция меди с кислородом: медь может реагировать с кислородом из воздуха, образуя оксид меди (II) или медь (I). Если медь нагревается на воздухе, она покрывается тонким слоем черного оксида CuO. Если медь нагревается вне контакта с воздухом, она образует оксид меди (I) - красное вещество Cu2O. Оба оксида меди широко используются в качестве пигментов, а также в производстве электродных материалов и керамики.
2. Реакция меди с кислотами: медь может реагировать с различными кислотами, образуя соли меди и выделяя водород. Например, при взаимодействии с серной кислотой образуется сульфат меди (II) и выделяется газообразный водород. Эта реакция может быть полезна для получения соли меди или в процессе очистки меди от примесей.
3. Реакция меди с азотными кислотами: медь может реагировать с азотными кислотами, например, с концентрированной азотной кислотой, образуя нитрат меди (II) и выделяя оксиды азота и воду. Эта реакция может быть опасной, так как азотные оксиды являются ядовитыми и являются причиной формирования смога.
4. Реакция меди с хлоридами: медь может реагировать с хлоридами, образуя хлорид меди (I) или хлорид меди (II). Например, с хлороводородной кислотой образуется хлорид меди (I) или медь (I) хлорид, который может быть использован в качестве каталитического средства в органическом синтезе.
Влияние условий на протекание реакции
Процесс реакции металла меди с серой может существенно зависеть от условий, в которых происходит реакция. Различия в температуре, концентрации реагентов и окружающей среды могут оказывать влияние на скорость и характер реакции.
Температура: Одним из главных факторов, влияющих на протекание реакции, является температура. Увеличение температуры обычно приводит к ускорению химической реакции, поскольку это увеличивает скорость движения молекул и частиц, что способствует частому столкновению реагентов.
Концентрация реагентов: Концентрация меди и серы влияет на протекание реакции. Увеличение концентрации одного или обоих реагентов может способствовать ускорению реакции, поскольку большее количество реагентов увеличивает вероятность их столкновения. Однако при слишком высокой концентрации реагентов могут возникнуть побочные реакции или измениться путь реакции.
Окружающая среда: Окружающая среда, в которой происходит реакция, также может оказывать влияние на протекание реакции. Наличие катализаторов или других веществ может ускорить реакцию или изменить ее путь. Также pH окружающей среды может оказывать влияние на ионизацию реагентов и скорость их реакции.
В целом, условия, в которых происходит реакция металла меди с серой, имеют важное значение для ее протекания. Изменение температуры, концентрации реагентов и окружающей среды может существенно влиять на скорость и характер реакции, что делает изучение этих условий важной задачей для понимания процессов химических реакций.
Вопрос-ответ
Что такое уравнение реакции металла меди с серой?
Уравнение реакции металла меди с серой показывает, как медь, металл, взаимодействует с серой, неметаллом, образуя соединение меди с серой.
Как можно записать уравнение реакции металла меди с серой?
Уравнение можно записать следующим образом: Cu + S -> CuS, где Cu обозначает медь, S - серу, а CuS - соединение меди с серой (сульфид меди).
Как происходит реакция металла меди с серой?
Реакция металла меди с серой происходит путем соединения атомов меди (Cu) с атомами серы (S), образуя соединение меди с серой (CuS).
Чем может быть полезно знание уравнения реакции металла меди с серой?
Знание уравнения реакции металла меди с серой может быть полезно при изучении химических реакций, в особенности в области металлургии и обработки металлов, также может быть полезно при анализе химических процессов в природе и промышленности.