Оксиды металлов являются одними из наиболее распространенных типов неорганических соединений. Они обладают широким спектром свойств и играют важную роль в различных химических процессах. Ключевым аспектом понимания и использования оксидов металлов является уравнение их диссоциации.
Уравнение диссоциации оксидов металлов описывает процесс распада этих соединений на ионы металла и кислорода в присутствии воды или других соединений. Данная реакция является основой многих химических превращений, таких как окисление и восстановление металлов.
Оксиды металлов могут образовываться при сжигании металлов или в результате реакции металла с кислородом. При диссоциации оксиды металлов отдают обратно кислород и превращаются в соответствующие металлические ионы. Это позволяет использовать оксиды металлов в качестве окислителей или катализаторов в химических реакциях.
Изучение уравнения диссоциации оксидов металлов позволяет понять и предсказать их реакционную активность, различные свойства и возможные области применения.
Понимание диссоциации оксидов металлов является фундаментом для развития различных технологий, таких как производство металлических сплавов, керамики, электродных материалов, а также в области энергетики и катализа. Данные соединения играют важную роль в многих отраслях промышленности и науки, и понимание их свойств и реакций является необходимым условием для развития новых технологий и материалов.
Уравнение диссоциации оксидов металлов

Оксиды металлов – это соединения металлов с кислородом. Они широко распространены в природе и имеют различные свойства. При растворении в воде оксиды металлов могут диссоциировать, то есть разлагаться на ионы металла и кислородные ионы.
Уравнение диссоциации оксидов металлов позволяет описать этот процесс химически. Обычно оно записывается в виде:
MnOm → nMm+ + mO2-
где M – символ металла, n – его заряд в оксиде, m – количество кислорода.
Например, диссоциация оксида железа(III) (Fe2O3) протекает по следующему уравнению:
Fe2O3 → 2Fe3+ + 3O2-
Уравнение диссоциации оксидов металлов позволяет определить ионы, образующиеся в растворе, а также стехиометрические соотношения между ними. Это важная информация для понимания химических реакций, происходящих с оксидами металлов.
Понимание реакций и свойств
Уравнение диссоциации оксидов металлов представляет собой описание реакции, при которой оксид металла разлагается на металл и кислород. Это особенно важно в контексте изучения химических свойств металлов и их соединений.
Понимание реакций диссоциации оксидов металлов позволяет предсказывать и объяснять их свойства. Например, зная уравнение диссоциации оксида железа (Fe2O3 → 2Fe + 1.5O2), можно сделать вывод о том, что оксид железа будет окисляться в присутствии кислорода, обладать красно-коричневой окраской и образовывать ржавчину.
Также, понимание реакций диссоциации оксидов металлов позволяет определить их режим работы в различных процессах. Например, оксид алюминия (Al2O3) может выступать в роли катализатора, представляя собой активную поверхность, на которой происходят химические реакции.
Другим важным аспектом понимания реакций и свойств оксидов металлов является изучение их влияния на окружающую среду. Некоторые оксиды металлов обладают высокой токсичностью или могут приводить к загрязнению атмосферы. Поэтому, разработка методов обезвреживания и утилизации оксидов металлов является актуальным направлением исследований в сфере экологии и охраны окружающей среды.
Классификация оксидов металлов
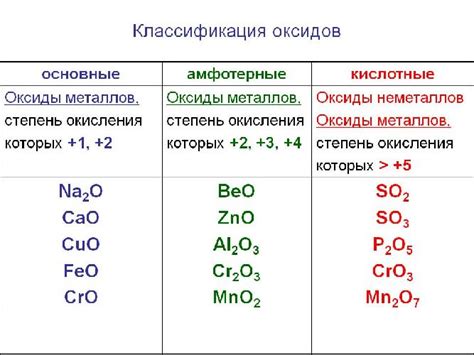
Оксиды металлов могут быть классифицированы в зависимости от их состава, структуры и физических свойств. Эта классификация позволяет более точно описывать реакции и свойства оксидов, а также определять их применение в различных областях промышленности и научных исследований.
Первая группа оксидов - базовые оксиды. Они обладают щелочными свойствами и образуют щелочные растворы при взаимодействии с водой. Примером таких оксидов является оксид кальция (CaO), который реагирует с водой, образуя щелочь (гидроксид кальция) и выделяя большое количество тепла.
Вторая группа оксидов - амфотерные оксиды. Они обладают как щелочными, так и кислотными свойствами и могут проявлять себя в зависимости от условий реакции. Примерами амфотерных оксидов являются оксид алюминия (Al2O3) и оксид железа (Fe2O3), которые могут реагировать как с кислотами, так и с щелочами.
Третья группа оксидов - кислотные оксиды. Они обладают кислыми свойствами и образуют кислоты при взаимодействии с водой. Примерами кислотных оксидов являются оксид серы (SO2), который реагирует с водой, образуя серную кислоту (H2SO4), и оксид углерода (CO2), который растворяется в воде, образуя угольную кислоту (H2CO3).
Четвертая группа оксидов - неоксидные соединения. Они представляют собой соединения металлов с элементами неоксидной группы, такими как азот, сера и хлор. Примером неоксидного соединения является оксид азота (NO), который играет важную роль в атмосферных реакциях и обладает ядовитыми свойствами.
Таким образом, классификация оксидов металлов позволяет систематизировать и описывать их свойства и реакции, что является важным для понимания и использования этих соединений в различных областях науки и промышленности.
Зависимость диссоциации от степени окисления
Диссоциация оксидов металлов – это процесс, в результате которого оксиды расщепляются на ионы металла и кислорода. Степень окисления, т.е. количество электронов, которые металл отдал или принял при образовании оксида, играет важную роль в этом процессе.
Чем выше степень окисления металла, тем больше ионы он образует при диссоциации оксида. Например, оксид меди (II), CuO, при диссоциации разлагается на один ион меди (II) и один ион кислорода. В то же время, оксид меди (I), Cu2O, при диссоциации расщепляется на два иона меди (I) и один ион кислорода.
Из этого следует, что степень окисления металла влияет на количество ионов, образующихся при диссоциации оксида. Чем выше степень окисления, тем больше ионов металла образуется при диссоциации, что может влиять на реакционную способность оксида.
Однако стоит отметить, что зависимость диссоциации от степени окисления не является единственным фактором, влияющим на реакционную способность оксидов металлов. Другие факторы, такие как размер и заряд ионов металла, состав оксида и наличие дополнительных групп, могут также влиять на свойства и поведение оксидов.
В целом, понимание зависимости диссоциации оксидов металлов от их степени окисления позволяет лучше понять реакционную способность и свойства этих соединений.
Физические свойства оксидов металлов

Оксиды металлов представляют собой химические соединения, состоящие из металлического катиона и кислородного аниона. Они обладают разнообразными физическими свойствами, которые определяют их поведение в различных условиях.
Точка плавления и кипения. Большинство оксидов металлов являются кристаллическими веществами с высокими точками плавления и кипения. Например, оксид алюминия (Al2O3) имеет точку плавления около 2072°C, а оксид железа (Fe2O3) - около 1565°C.
Твердотельные свойства. Оксиды металлов обычно являются твердыми веществами при комнатной температуре. Они обладают хрупкостью и могут иметь различные структуры: ионную решетку, молекулярную структуру или смесь обоих.
Цвет и прозрачность. Оксиды металлов могут иметь разные цвета, от белого и безцветного до различных оттенков желтого, красного, синего и даже черного. Некоторые оксиды металлов, такие как оксид меди (CuO) и оксид хрома (Cr2O3), обладают свойством прозрачности и используются в оптических приборах.
Электрические свойства. Некоторые оксиды металлов могут проводить электрический ток, а другие - нет. Металлические оксиды, такие как оксид меди (CuO), могут служить как полупроводники или даже проводники при определенных условиях.
Растворимость. Растворимость оксидов металлов в воде может быть разной. Некоторые оксиды, например оксид натрия (Na2O), растворяются в воде, образуя щелочные растворы, а другие оксиды, например оксид свинца (PbO), практически нерастворимы в воде.
Плотность и твердость. Оксиды металлов обычно обладают высокой плотностью и твердостью. Например, оксид алюминия (Al2O3) имеет плотность около 4 г/см3 и твердость 9 по шкале Мооса.
В целом, физические свойства оксидов металлов зависят от их структуры, композиции и способа получения. Эти свойства делают их полезными в различных областях, таких как керамика, электроника, катализ и многое другое.
Химические свойства оксидов металлов
Оксиды металлов представляют собой соединения металлов с кислородом. Они обладают рядом химических свойств, которые определяют их важную роль в различных процессах и применениях.
Одной из основных характеристик оксидов металлов является их реакционная способность. Оксиды металлов способны взаимодействовать с различными веществами и проявлять кислотные или щелочные свойства. Некоторые оксиды металлов обладают амфотерным характером и могут действовать как кислоты или щелочи в зависимости от условий реакции.
Оксиды металлов также могут подвергаться реакции с водой и образовывать гидроксиды металлов. Реакция оксида с водой часто сопровождается выделением тепла и образованием соответствующего гидроксида. Это свойство оксидов металлов широко используется в различных производственных процессах, например, при получении щелочей и кислот.
Важным химическим свойством оксидов металлов является их способность окислять или восстанавливать другие вещества. Многие оксиды металлов являются окислами и могут передавать кислородные атомы другим веществам. Это свойство оксидов металлов играет важную роль в ряде химических процессов, таких как коррозия металлов, сгорание и окисление органических веществ.
Также оксиды металлов могут служить катализаторами различных химических реакций. Они способны ускорять реакцию без участия в ее конечном результате. Это делает оксиды металлов важными компонентами многих катализаторов, используемых в химической промышленности.
Взаимодействие оксидов металлов с водой и кислотами

Оксиды металлов — это неорганические соединения, состоящие из кислорода и одного или нескольких металлов. Эти соединения обладают способностью высвобождать кислород при взаимодействии с водой и кислотами.
Взаимодействие оксидов металлов с водой может протекать по нескольким реакциям. Очень часто оксиды металлов диссоциируют с образованием основания. Например, оксид железа FeO при контакте с водой превращается в гидроксид железа Fe(OH)2. В реакции выделяется кислород, который может реагировать с другими веществами, например, такими как водород или углерод.
Взаимодействие оксидов металлов с кислотами приводит к образованию солей. Если писать уравнение реакции, то можно записать его в виде: "оксид металла + кислота → соль + вода". Например, оксид алюминия Al2O3 при взаимодействии с серной кислотой H2SO4 образует соль алюминия и серную кислоту: Al2(SO4)3 + H2O.
Также оксиды металлов могут реагировать с кислотами, образуя воду и обратимые соединения. Например, оксид меди CuO при взаимодействии с соляной кислотой HCl образует хлорид меди CuCl2 и воду: CuO + 2HCl → CuCl2 + H2O.
Таким образом, взаимодействие оксидов металлов с водой и кислотами является важным процессом, который приводит к образованию оснований и солей, а также может сопровождаться выделением воды и обратимой реакцией.
Роль оксидов металлов в промышленных процессах
Оксиды металлов играют важную роль в промышленных процессах. Они являются основой для производства множества материалов и веществ, используемых в различных отраслях промышленности. Они широко применяются в металлургии, химической промышленности, стекольной промышленности и в производстве электроники.
Одной из основных функций оксидов металлов является их роль в процессах окисления и восстановления. Они могут служить окислителями или восстановителями, что позволяет проводить управляемые химические реакции. Кроме того, оксиды металлов способны образовывать стабильные соединения с другими элементами, что делает их ценным сырьем для производства различных продуктов.
В металлургии оксиды металлов используются для получения металлов. Например, оксид железа (Fe2O3) служит сырьем для производства чугуна, а оксид алюминия (Al2O3) используется для получения алюминия. Оксиды металлов также применяются в процессах легирования металлов, что позволяет улучшить их свойства и придать им определенные характеристики.
Оксиды металлов нашли широкое применение в химической промышленности. Они служат сырьем для получения различных химических соединений. Например, оксид кальция (CaO) используется при производстве цемента, а оксиды цинка (ZnO) и свинца (PbO) используются для получения пигментов, используемых в производстве красок и лаков.
Оксиды металлов также играют важную роль в стекольной промышленности. Они используются для придания стеклу определенных свойств, таких как прозрачность, прочность и химическая устойчивость. Например, оксид кремния (SiO2) используется при производстве стекла, а оксид бора (B2O3) добавляется для придания стеклу высокой термостойкости.
Наконец, оксиды металлов широко применяются в производстве электроники. Они используются для создания полупроводниковых материалов, которые в свою очередь применяются в производстве микрочипов, лазеров и других электронных компонентов. Оксиды металлов обладают особыми электрическими свойствами, что делает их ценными материалами в этой области.
Вопрос-ответ
Что такое уравнение диссоциации оксидов металлов?
Уравнение диссоциации оксидов металлов описывает процесс, при котором оксиды металлов разделяются на ионы металла и ионы кислорода. В результате диссоциации образуются ионы, которые могут обладать разными зарядами в зависимости от степени окисления металла.
Какие свойства имеют оксиды металлов?
Оксиды металлов обладают различными свойствами в зависимости от характера металла и его оксидации. Некоторые оксиды металлов являются основаниями и реагируют с кислотами, образуя соли и воду. Другие оксиды металлов могут быть кислотными и реагировать с основаниями, образуя соли и воду. Также существуют оксиды, которые могут выступать и как основания, и как кислоты, реагируя как с кислотами, так и с основаниями.
Какие реакции происходят при диссоциации оксидов металлов?
При диссоциации оксидов металлов происходит разделение оксидов на ионы металла и ионы кислорода. Например, при диссоциации оксида железа(III) получаются ионы железа(III) Fe3+ и ионы кислорода O2-. Уравнение реакции диссоциации определяется степенью окисления металла и его электрохимическим потенциалом.
Какие факторы влияют на диссоциацию оксидов металлов?
Факторы, влияющие на диссоциацию оксидов металлов, включают температуру, давление и концентрацию оксидов. При повышении температуры обычно увеличивается скорость диссоциации, а при изменении давления или концентрации оксида можно изменить равновесие реакции.
Какие особенности имеет диссоциация оксидов металлов в водных растворах?
Диссоциация оксидов металлов в водных растворах может протекать с образованием гидроксидов и оксокислот металлов. Например, диссоциация оксида железа(III) в воде приводит к образованию гидроксида железа(III) и оксокислоты железа(III). Такие реакции имеют важное значение в химии металлов.
