Взаимодействие 115 г одновалентного металла с водой является одной из важных реакций в химии. Под одновалентными металлами понимаются элементы, имеющие одну валентность, то есть способные образовывать соединения с другими элементами, поглощая или отдавая одну электрон.
Во время взаимодействия одновалентного металла с водой происходит деликатный процесс, который сопровождается выделением водорода. В результате этой реакции образуется гидроксид металла и выделяется молекулярный водород. Образовавшийся гидроксид металла может быть растворимым или нерастворимым в воде.
Выделение 56 л водорода в данном контексте является результатом точного расчёта. Оно представляет собой теоретическое количество водорода, которое можно выделить при взаимодействии 115 г одновалентного металла с водой. Водород является лёгким и самым распространённым элементом во Вселенной. Он используется в различных отраслях промышленности, науки и повседневной жизни человека.
Особенности реакции металла с водой

Реакция металла с водой является одной из важных химических реакций и происходит с выделением водорода. Данная реакция обладает несколькими особенностями, которые связаны как с характером взаимодействия, так и с особенностями самих металлов.
Во-первых, не все металлы реагируют с водой. Например, некоторые металлы, такие как золото или платина, не реагируют с водой в обычных условиях. Однако металлы, относящиеся к группе 1 (щелочные металлы), такие как литий, натрий и калий, реагируют очень активно.
Во-вторых, скорость реакции металла с водой зависит от его активности. Щелочные металлы реагируют с водой быстро и сильно, выделяя большое количество водорода. Металлы из группы 2 (щёлочноземельные металлы), такие как магний или кальций, тоже реагируют с водой, но менее активно по сравнению со щелочными металлами.
В-третьих, реакция металла с водой может быть сопровождена плаванием и "танцами" металлического образца на поверхности воды. Это происходит из-за образования водорода, который поднимается вверх, образуя пузырьки.
Таким образом, реакция металла с водой имеет свои особенности, которые определяются как химическими свойствами металла, так и условиями проведения эксперимента. Изучение данной реакции позволяет лучше понять химические свойства металлов и их взаимодействие с другими веществами.
Механизм образования водорода
Механизм образования водорода в процессе взаимодействия 115 г одновалентного металла с водой является достаточно сложным и увлекательным. В результате этого процесса происходит разложение воды на два компонента - водород и кислород.
В начале реакции металл взаимодействует с водой, образуя гидроксид металла и выделяяся водородный газ. Например, при взаимодействии натрия с водой образуется гидроксид натрия (NaOH) и выделяется водород газ (H2). Эта реакция происходит из-за высокой активности одновалентных металлов.
Гидроксид металла, образовавшийся в результате реакции, может дальше взаимодействовать с водой, создавая щелочную среду. Щелочная среда способствует дополнительной реакции с водой, в результате которой вода диссоциирует на ионы водорода и гидроксидные ионы.
Ионы водорода вступают в реакцию с одним из металлов, образующих гидроксид. В результате этой реакции образуется металлический водород, который выделяется в виде газа из водной среды.
Таким образом, механизм образования водорода в процессе взаимодействия 115 г одновалентного металла с водой связан с образованием гидроксида металла, его диссоциацией, реакцией ионов водорода с металлом и выделением газообразного водорода.
Влияние условий на скорость реакции
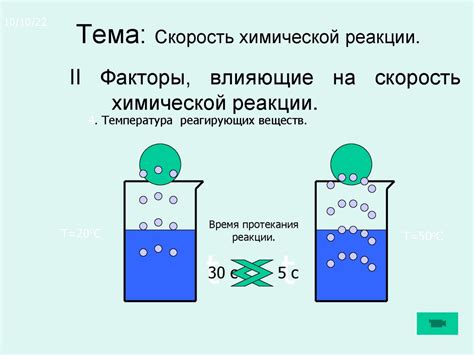
Скорость реакции при взаимодействии 115 г одновалентного металла с водой и выделении 56 л водорода может зависеть от различных условий. Одним из факторов, влияющих на скорость реакции, является температура. При повышении температуры реакция может протекать более быстро, так как увеличивается энергия частиц, что способствует их активности и столкновениям. С другой стороны, снижение температуры может замедлить реакцию и снизить скорость выделения водорода.
Еще одним важным фактором, влияющим на скорость реакции, является концентрация веществ. При увеличении концентрации металла или воды реакция может происходить быстрее, так как увеличивается количество частиц, готовых к реакции. В то же время, низкая концентрация может замедлить реакцию и снизить скорость выделения водорода.
Еще одним фактором, влияющим на скорость реакции, является наличие катализатора. Катализаторы могут ускорить химическую реакцию, участвуя в промежуточных стадиях и снижая энергию активации. Наличие катализатора может значительно повысить скорость выделения водорода при взаимодействии одновалентного металла с водой.
Также важную роль влияние pH-среды на скорость реакции. Протекание реакции может быть оптимально при определенном pH, при котором наиболее благоприятные условия для взаимодействия металла с водой и выделения водорода.
Различные способы выделения водорода
1. Разложение воды электролизом:
Один из самых распространенных способов выделения водорода - это разложение воды с помощью электролиза. При этом методе вода разделяется на кислород и водород с использованием электрического тока. Водород отделяется на отрицательном электроде - катоде, а кислород - на положительном электроде - аноде.
2. Выделение водорода реакцией металла с кислотой:
Другой способ получения водорода - это реакция металла с кислотой. Например, одновалентные металлы, такие как натрий или калий, могут реагировать с водой, образуя водород. При этом реакции обычно протекают быстро и с выделением большого количества газа.
3. Использование химических реакций:
Также водород можно получить с помощью некоторых химических реакций. Например, одним из способов является реакция металла с кислородом или его соединениями, например, оксидом металла. В результате реакции образуется вода и выделяется водород.
4. Выделение водорода из гидридов:
Гидриды представляют собой соединения вещества с водородом. В некоторых случаях можно выделить водород из гидридов путем применения тепла или с помощью реакции с другими веществами. Например, выделение водорода из металлических гидридов может осуществляться путем нагрева или реакции с кислотами.
Применение выделенного водорода
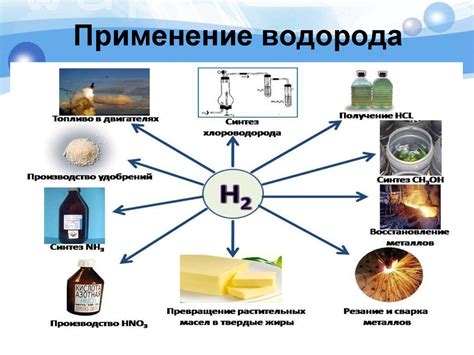
Выделенный водород, полученный в результате взаимодействия 115 г одновалентного металла с водой, имеет широкий спектр применений в различных отраслях промышленности и научных исследований.
Одним из наиболее важных применений выделенного водорода является его использование в производстве аммиака. Водород служит важным сырьем для химического синтеза аммиака, который затем применяется в качестве удобрения в сельском хозяйстве. Аммиак также используется в производстве нитратов, подкисления вин и регенерации катализаторов. Таким образом, выделенный водород играет ключевую роль в обеспечении продовольственной безопасности и развитии сельского хозяйства.
Выделенный водород также широко используется в качестве энергетического ресурса. Его можно использовать как топливо для производства электричества и привода транспортных средств. Водородные топливные элементы становятся все более популярными в сфере обновляемой энергетики, так как водород является экологически чистым и не имеет выбросов вредных веществ. Таким образом, выделенный водород способствует устойчивому развитию энергетической отрасли и сокращению использования углеводородных ископаемых.
Кроме того, выделенный водород имеет применение в производстве стекла, металлургии, электронной промышленности и фармацевтике. Водород используется для получения чистых и высококачественных материалов, в процессах нагрева и пайки металлических изделий, а также в производстве лекарственных препаратов. Также водород используется в аналитической химии, физике и других научных исследованиях в качестве газа-носителя или реактивного вещества.
Таким образом, выделенный водород, полученный в результате взаимодействия 115 г одновалентного металла с водой, является ценным сырьем и ресурсом, который находит широкое применение в различных отраслях промышленности и научных исследований.
Перспективы использования этого метода
Метод взаимодействия 115 г одновалентного металла с водой и выделение 56 л водорода представляет собой перспективный способ получения водорода, который широко используется в различных сферах нашей жизни.
Во-первых, этот метод может быть использован в индустрии. Водород является важным компонентом для производства различных химических соединений, таких как аммиак, метанол, метан, водородная пероксид и др. Поэтому использование этого метода может значительно упростить производство этих веществ.
Во-вторых, водород используется в качестве топлива. Он обладает большим энергетическим потенциалом и может быть использован в различных транспортных средствах, таких как автомобили и авиационные двигатели. При этом выделение водорода из одновалентного металла с водой может стать эффективным и экологически чистым способом получения топлива.
Также, данный метод может быть использован в энергетике. Водород может быть использован для производства электроэнергии в водородных топливных элементах. В современных условиях постепенного исчерпания углеводородных запасов, использование данного метода может стать рациональным решением для обеспечения потребностей в электроэнергии в будущем.
Вопрос-ответ
Какой металл используется для выделения водорода в этом эксперименте?
В эксперименте используется одновалентный металл весом 115 г.
Какой объем водорода образуется при взаимодействии металла с водой?
При взаимодействии 115 г одновалентного металла с водой образуется 56 литров водорода.
Каковы особенности этого эксперимента?
Особенностью данного эксперимента является использование одновалентного металла, который реагирует с водой, образуя большой объем водорода.
Какие еще вещества образуются при взаимодействии металла с водой?
При взаимодействии металла с водой, помимо водорода, могут образовываться различные соли и гидроксиды в зависимости от химического свойства металла.
Каким образом проводится выделение водорода в данном эксперименте?
Для выделения водорода в данном эксперименте металл реагирует с водой, при этом выделяется газ, который собирается и измеряется по объему.
Какие приложения может иметь эта реакция выделения водорода?
Реакция выделения водорода может иметь широкое применение в различных сферах, таких как энергетика, химическая промышленность и транспорт, так как водород является эффективным и экологически чистым источником энергии.
Какой вклад в развитие науки может внести данное исследование?
Данное исследование может способствовать развитию науки, помогая лучше понять химические свойства металлов и разработать новые эффективные способы производства и использования водорода.
